第38页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
10.下表是部分城市某日空气质量日报:
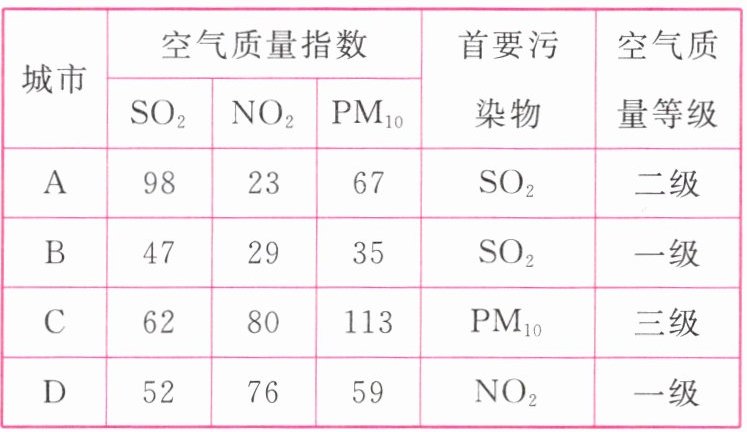
(1)由上表可知,空气质量日报中涉及的污染物主要是____SO₂、NO₂____和可吸入颗粒物(PM₁₀)。
(2)SO₂的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如下:
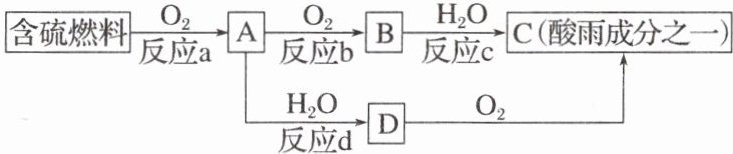
请回答下列问题:
①酸雨的pH____<____(填“>”“<”或“=”)5.6。
②反应b的化学方程式为____2H₂SO₃ + O₂ = 2H₂SO₄____。
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是____2H₂SO₃ + O₂ = 2H₂SO₄____。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:____SO₂ + 2OH⁻ = SO₃²⁻ + H₂O____。

(1)由上表可知,空气质量日报中涉及的污染物主要是____SO₂、NO₂____和可吸入颗粒物(PM₁₀)。
(2)SO₂的排放是造成酸雨的主要因素。形成酸雨的原因之一可简单表示如下:

请回答下列问题:
①酸雨的pH____<____(填“>”“<”或“=”)5.6。
②反应b的化学方程式为____2H₂SO₃ + O₂ = 2H₂SO₄____。
③在一段时间内连续不断测定溶液D的pH,发现pH变小,表示该变化的化学方程式是____2H₂SO₃ + O₂ = 2H₂SO₄____。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:____SO₂ + 2OH⁻ = SO₃²⁻ + H₂O____。
答案:
(1)$SO_{2}$、$NO_{2}$ (2)①< ②$2SO_{2}+O_{2}\stackrel{催化剂}{\underset{\triangle}{\rightleftharpoons}}2SO_{3}$ ③$2H_{2}SO_{3}+O_{2}=2H_{2}SO_{4}$ ④$2OH^{-}+SO_{2}=SO_{3}^{2 - }+H_{2}O$
11.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生标准状况下的一氧化氮和二氧化氮混合气体共11.2L。请回答下列问题:
(1)产生一氧化氮的体积为____5.824____L(标准状况下)。
(2)待反应结束后,向溶液中加入VmL a mol·L⁻¹的氢氧化钠溶液,恰好使溶液中的Cu²⁺全部转化为沉淀,则原硝酸的浓度为____$\frac{10^{-3}Va + 0.5}{0.14}$____mol·L⁻¹(不必化简)。
(3)欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要氧气____0.255____mol。
(1)产生一氧化氮的体积为____5.824____L(标准状况下)。
(2)待反应结束后,向溶液中加入VmL a mol·L⁻¹的氢氧化钠溶液,恰好使溶液中的Cu²⁺全部转化为沉淀,则原硝酸的浓度为____$\frac{10^{-3}Va + 0.5}{0.14}$____mol·L⁻¹(不必化简)。
(3)欲使铜与硝酸反应生成的气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要氧气____0.255____mol。
答案:
(1)5.824 (2)$\frac{aV×10^{-3}+0.5}{0.14}$ (3)0.255
12.某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO₂能与NaOH溶液反应):
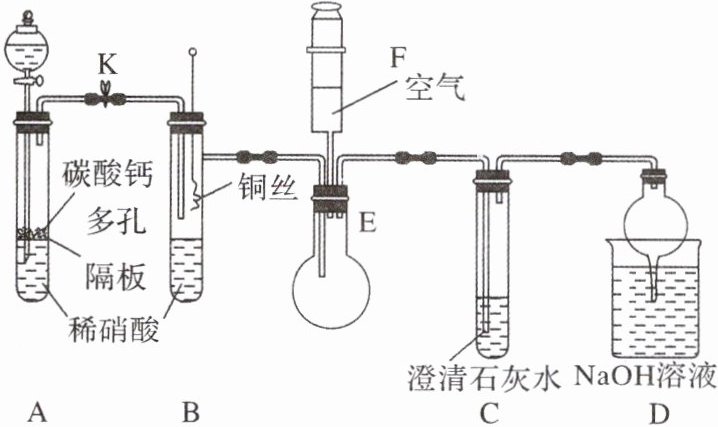
(1)设计装置A的目的是____利用生成的CO₂将装置内的空气排尽,防止NO被氧化____,为达此目的应进行的操作是____打开K,当装置C中产生白色沉淀时,关闭K____;A中反应的化学方程式是____CaCO₃ + 2HNO₃ = Ca(NO₃)₂ + H₂O + CO₂↑____。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸中,并微热之,观察到装置B中的现象是____铜丝表面产生气泡,溶液逐渐变蓝,液面上方气体由无色变为红棕色后又变为无色____;B中反应的离子方程式是____3Cu + 8H⁺ + 2NO₃⁻ = 3Cu²⁺ + 2NO↑ + 4H₂O____。
(3)装置E和F的作用是____验证无色气体为NO____;为实现此目的,操作方法是____打开F活塞,将空气推入E中____。
(4)D装置的作用是____吸收尾气,防止污染空气____。

(1)设计装置A的目的是____利用生成的CO₂将装置内的空气排尽,防止NO被氧化____,为达此目的应进行的操作是____打开K,当装置C中产生白色沉淀时,关闭K____;A中反应的化学方程式是____CaCO₃ + 2HNO₃ = Ca(NO₃)₂ + H₂O + CO₂↑____。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸中,并微热之,观察到装置B中的现象是____铜丝表面产生气泡,溶液逐渐变蓝,液面上方气体由无色变为红棕色后又变为无色____;B中反应的离子方程式是____3Cu + 8H⁺ + 2NO₃⁻ = 3Cu²⁺ + 2NO↑ + 4H₂O____。
(3)装置E和F的作用是____验证无色气体为NO____;为实现此目的,操作方法是____打开F活塞,将空气推入E中____。
(4)D装置的作用是____吸收尾气,防止污染空气____。
答案:
(1)利用生成的$CO_{2}$将整套装置内的空气赶尽,以排除对气体产物观察的干扰 打开K,当装置C中产生白色沉淀时,关闭K $CaCO_{3}+2HNO_{3}=Ca(NO_{3})_{2}+CO_{2}\uparrow +H_{2}O$ (2)铜丝上产生气泡,稀硝酸液面上气体仍无色,溶液变为蓝色 $3Cu + 8H^{+}+2NO_{3}^{-}=3Cu^{2+}+2NO\uparrow +4H_{2}O$ (3)验证B中产生的无色气体为$NO$ 将注射器F中的空气推入E中 (4)吸收$NO$、$NO_{2}$等尾气,防止污染空气
查看更多完整答案,请扫码查看


