第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
跟踪训练 3 [2025·江苏连云港]通过数字化实验探究 NaOH 的性质。
实验 1:在盛有 NaOH 固体的密闭容器中,水蒸气含量随时间的变化如图甲所示。
实验 2:取长期放置后的 NaOH 固体于烧杯中,加水溶解冷却至室温,加入 BaCl₂固体,溶液 pH 随时间的变化如图乙所示。
实验 3:向一定体积 NaOH 溶液中滴加稀盐酸,混合溶液的 pH 随加入稀盐酸体积的变化如图丙所示。

已知:BaCl₂易溶于水,且溶液呈中性。
下列说法正确的是( )
A.图甲证明 NaOH 固体能吸收 CO₂和 H₂O 而变质
B.图乙中 ab 段 pH 下降证明 NaOH 能与 BaCl₂发生复分解反应
C.向图丙中 c 点所得溶液滴加无色酚酞试液,溶液显红色
D.图丙中 d 点所得溶液中 Na⁺的个数小于 Cl⁻的个数
实验 1:在盛有 NaOH 固体的密闭容器中,水蒸气含量随时间的变化如图甲所示。
实验 2:取长期放置后的 NaOH 固体于烧杯中,加水溶解冷却至室温,加入 BaCl₂固体,溶液 pH 随时间的变化如图乙所示。
实验 3:向一定体积 NaOH 溶液中滴加稀盐酸,混合溶液的 pH 随加入稀盐酸体积的变化如图丙所示。

已知:BaCl₂易溶于水,且溶液呈中性。
下列说法正确的是( )
A.图甲证明 NaOH 固体能吸收 CO₂和 H₂O 而变质
B.图乙中 ab 段 pH 下降证明 NaOH 能与 BaCl₂发生复分解反应
C.向图丙中 c 点所得溶液滴加无色酚酞试液,溶液显红色
D.图丙中 d 点所得溶液中 Na⁺的个数小于 Cl⁻的个数
答案:
D
典例 4 [2024·江苏启东二模]SO₂是酸雨成因之一,学习小组围绕 SO₂展开探究活动。
活动Ⅰ.检测某地区雨水的 pH 值
(1)收集了一些刚降落的雨水,用 pH 计每隔 1h 测定雨水的 pH,数据如表所示:
①该雨水_________(选填“属于”或“不属于”)酸雨。
②在测定期间,雨水的酸性_________(选填“增强”或“减弱”)。
③查阅资料,雨水 pH 变化的原因是雨水中的 H₂SO₃被空气中的 O₂氧化成 H₂SO₄,写出该反应的化学方程式:_________。
活动Ⅱ.探究 SO₂水溶液的成分
(2)向 SO₂水溶液中滴加 NaOH 溶液,测得溶液中含硫微粒的分布百分数随 pH 变化如图所示。
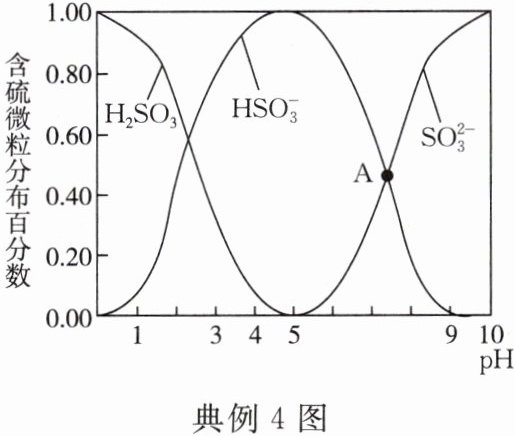
①NaHSO₃溶液呈_________(选填“酸性”或“碱性”)。
②A 点溶液含有的溶质主要为_________(填化学式)。
(3)取久置后的 SO₂水溶液于试管中,向其中滴加过量的 Ba(OH)₂溶液,有沉淀产生。
【提出问题】该沉淀是什么?
【查阅资料】
①SO₂能使品红溶液褪色。
②BaSO₃和 BaSO₄都难溶于水。
③BaSO₃能溶于浓度较大的盐酸生成 SO₂,BaSO₄不溶于盐酸。
【提出猜想】沉淀可能为 BaSO₄或 BaSO₄、BaSO₃的混合物。
【实验验证】请设计实验验证沉淀是 BaSO₄、BaSO₃的混合物。简述实验过程(包括操作和现象):_________(实验中须使用的试剂:10%的盐酸、品红溶液)。
活动Ⅲ.寻找防治的办法
(4)用 CO 处理 SO₂的原理为$ 2CO + SO₂\xlongequal{\gamma - Al₂O₃}2CO₂ + S,$反应中 SO₂体现_________性。
(5)对酸化的土壤,可选用_________进行改良。
活动Ⅰ.检测某地区雨水的 pH 值
(1)收集了一些刚降落的雨水,用 pH 计每隔 1h 测定雨水的 pH,数据如表所示:
①该雨水_________(选填“属于”或“不属于”)酸雨。
②在测定期间,雨水的酸性_________(选填“增强”或“减弱”)。
③查阅资料,雨水 pH 变化的原因是雨水中的 H₂SO₃被空气中的 O₂氧化成 H₂SO₄,写出该反应的化学方程式:_________。
活动Ⅱ.探究 SO₂水溶液的成分
(2)向 SO₂水溶液中滴加 NaOH 溶液,测得溶液中含硫微粒的分布百分数随 pH 变化如图所示。

①NaHSO₃溶液呈_________(选填“酸性”或“碱性”)。
②A 点溶液含有的溶质主要为_________(填化学式)。
(3)取久置后的 SO₂水溶液于试管中,向其中滴加过量的 Ba(OH)₂溶液,有沉淀产生。
【提出问题】该沉淀是什么?
【查阅资料】
①SO₂能使品红溶液褪色。
②BaSO₃和 BaSO₄都难溶于水。
③BaSO₃能溶于浓度较大的盐酸生成 SO₂,BaSO₄不溶于盐酸。
【提出猜想】沉淀可能为 BaSO₄或 BaSO₄、BaSO₃的混合物。
【实验验证】请设计实验验证沉淀是 BaSO₄、BaSO₃的混合物。简述实验过程(包括操作和现象):_________(实验中须使用的试剂:10%的盐酸、品红溶液)。
活动Ⅲ.寻找防治的办法
(4)用 CO 处理 SO₂的原理为$ 2CO + SO₂\xlongequal{\gamma - Al₂O₃}2CO₂ + S,$反应中 SO₂体现_________性。

(5)对酸化的土壤,可选用_________进行改良。
答案:
(1)①属于 ②增强 ③$\mathrm{2H_2SO_3 + O_2 = 2H_2SO_4}$
(2)①酸性 ②$\mathrm{NaHSO_3}$、$\mathrm{Na_2SO_3}$
(3)向产生沉淀的试管中滴加过量的10%的盐酸,沉淀部分消失,生成的气体能使品红溶液褪色,说明该沉淀是$\mathrm{BaSO_4}$、$\mathrm{BaSO_3}$的混合物
(4)氧化
(5)熟石灰
(1)①属于 ②增强 ③$\mathrm{2H_2SO_3 + O_2 = 2H_2SO_4}$
(2)①酸性 ②$\mathrm{NaHSO_3}$、$\mathrm{Na_2SO_3}$
(3)向产生沉淀的试管中滴加过量的10%的盐酸,沉淀部分消失,生成的气体能使品红溶液褪色,说明该沉淀是$\mathrm{BaSO_4}$、$\mathrm{BaSO_3}$的混合物
(4)氧化
(5)熟石灰
跟踪训练 4 学习了酸雨及酸的性质后,同学们知道了煤(含有 C、H、O、S 等元素)燃烧产生的二氧化硫是形成酸雨的主要原因之一,学校项目化学习小组在老师的指导下开展了“模拟酸雨形成”的项目化学习。


【联想与实验】模仿二氧化碳与水反应进行如图 1 所示实验。
【问题与猜想】亚硫酸不稳定,为什么红色溶液微热后不变为紫色? 其原因可能为:
猜想Ⅰ.加热不够充分
猜想Ⅱ.与空气中氮气有关
猜想Ⅲ.与空气中氧气有关
【探究与验证】填写表格中的空格。
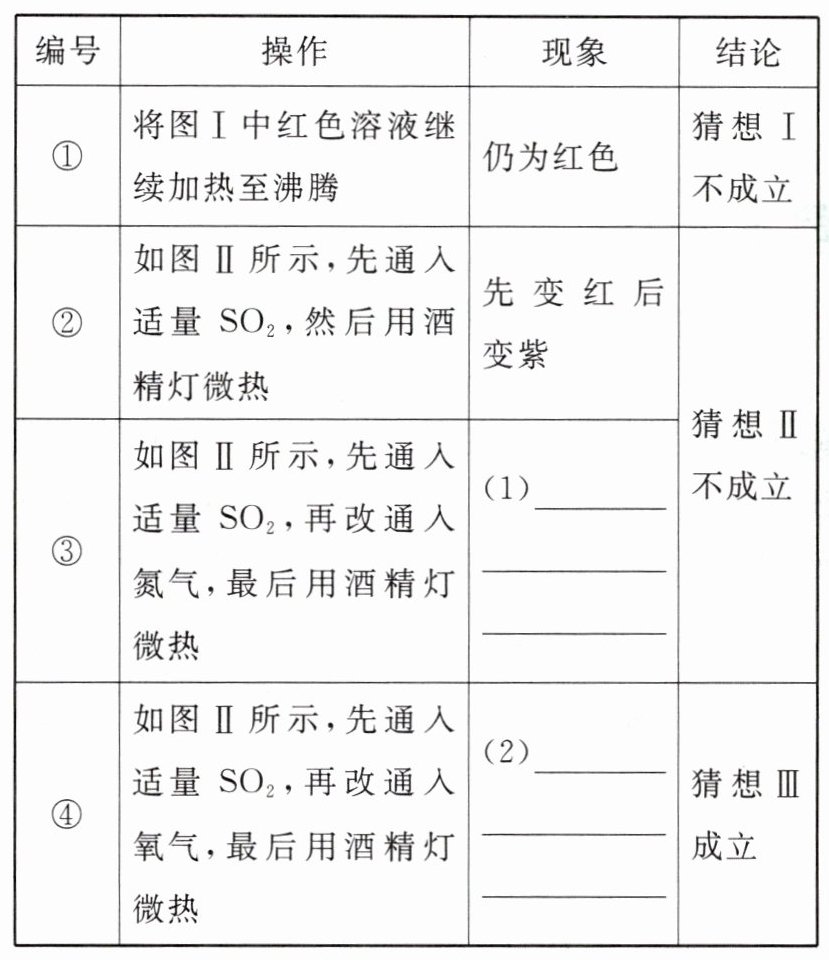
【分析与结论】红色溶液微热后不变为紫色的原因:H₂SO₃在空气中会被氧化生成另一种酸,进一步实验证明是硫酸。
【应用与拓展】同学们在老师指导下制作了“酸雨形成及危害的模型”来研究酸雨形成的原因及危害,并设计了评价表。图甲是小科制作的模型。
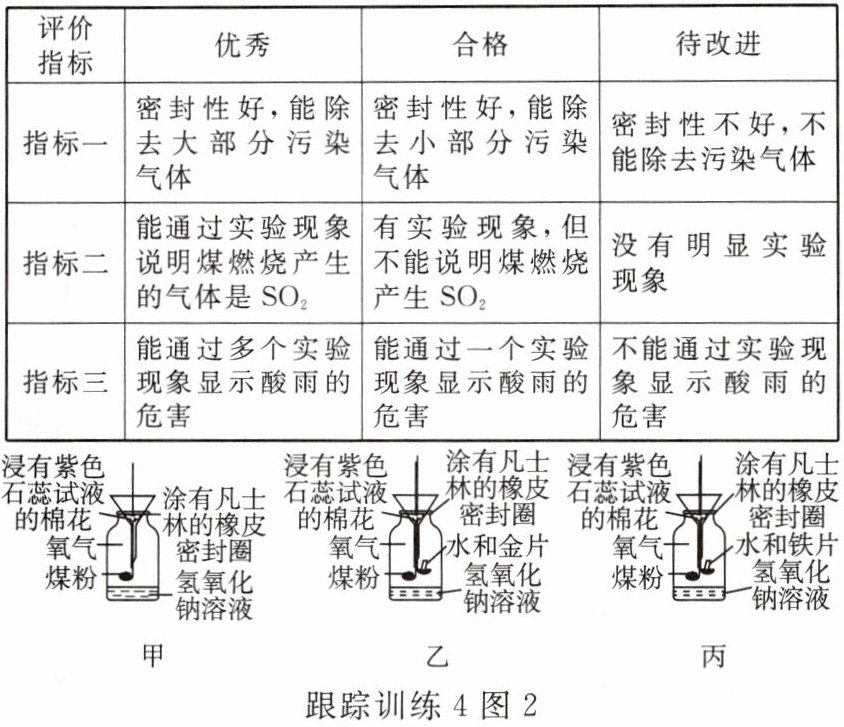
根据评价表,该模型的指标一可被评为优秀。因为该装置可以除去大部分污染气体,原因是氢氧化钠溶液具有吸收二氧化硫的性质。
(3)该模型的指标二被评为合格的原因是煤燃烧还能产生________气体,也能使浸有紫色石蕊试液的棉花变红。
(4)该模型的指标三被评为待改进,于是小科设计了图乙、图丙两种模型。这两种改进模型中,图________的模型的指标三能被评为合格。


【联想与实验】模仿二氧化碳与水反应进行如图 1 所示实验。
【问题与猜想】亚硫酸不稳定,为什么红色溶液微热后不变为紫色? 其原因可能为:
猜想Ⅰ.加热不够充分
猜想Ⅱ.与空气中氮气有关
猜想Ⅲ.与空气中氧气有关
【探究与验证】填写表格中的空格。

【分析与结论】红色溶液微热后不变为紫色的原因:H₂SO₃在空气中会被氧化生成另一种酸,进一步实验证明是硫酸。
【应用与拓展】同学们在老师指导下制作了“酸雨形成及危害的模型”来研究酸雨形成的原因及危害,并设计了评价表。图甲是小科制作的模型。

根据评价表,该模型的指标一可被评为优秀。因为该装置可以除去大部分污染气体,原因是氢氧化钠溶液具有吸收二氧化硫的性质。
(3)该模型的指标二被评为合格的原因是煤燃烧还能产生________气体,也能使浸有紫色石蕊试液的棉花变红。
(4)该模型的指标三被评为待改进,于是小科设计了图乙、图丙两种模型。这两种改进模型中,图________的模型的指标三能被评为合格。
答案:
(3)二氧化碳
(4)丙
(3)二氧化碳
(4)丙
查看更多完整答案,请扫码查看


