2025年走进重高培优测试九年级化学全一册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年走进重高培优测试九年级化学全一册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第112页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
13. 如图所示,在杠杆的两端分别挂着质量相等的铜球和锌球,这时杠杆平衡,然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻。下列说法中正确的是(

A.只有左边烧杯中溶液的质量增大
B.只有右边烧杯中溶液的质量增大
C.两边烧杯中溶液的质量都增大
D.去掉烧杯后,杠杆仍然保持平衡
B
)
A.只有左边烧杯中溶液的质量增大
B.只有右边烧杯中溶液的质量增大
C.两边烧杯中溶液的质量都增大
D.去掉烧杯后,杠杆仍然保持平衡
答案:
13.B 【解析】杠杆上挂的是两个球,由题意知,只有球的质量影响杠杆平衡,左边铜与稀硫酸不反应,右边锌置换出溶液中的铜,锌的相对原子质量为65,铜的相对原子质量为64,因为铜和锌都显+2价,所以一原子的锌置换出一原子的铜,则右边球的质量减小,同时溶液的质量变大。因为左边球的质量不变,右边球的质量变小,所以去掉烧杯后,杠杆不再保持平衡。
14. 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为$m$的锌粉,溶液中析出固体的质量与参加反应的锌粉质量的关系如图所示。下列说法中正确的是(
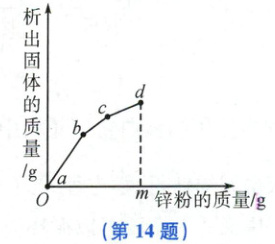
A.$c$点对应溶液中含有的金属离子为$Zn^{2+}$和$Cu^{2+}$
B.$b \sim c$段(不含两端点)析出的金属是$Fe$
C.$a \sim b$段(不含两端点)对应溶液中含有的金属离子为$Zn^{2+}$、$Ag^{+}$、$Cu^{2+}$和$Fe^{2+}$
D.若$b \sim c$段和$c \sim d$段中析出固体的质量相等,参加反应的锌粉质量分别为$m_{1}$和$m_{2}$,则$m_{1} > m_{2}$
C
)
A.$c$点对应溶液中含有的金属离子为$Zn^{2+}$和$Cu^{2+}$
B.$b \sim c$段(不含两端点)析出的金属是$Fe$
C.$a \sim b$段(不含两端点)对应溶液中含有的金属离子为$Zn^{2+}$、$Ag^{+}$、$Cu^{2+}$和$Fe^{2+}$
D.若$b \sim c$段和$c \sim d$段中析出固体的质量相等,参加反应的锌粉质量分别为$m_{1}$和$m_{2}$,则$m_{1} > m_{2}$
答案:
14.C 【解析】锌、铁、铜、银的金属活动性顺序为锌>铁>铜>银,往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,锌先与硝酸银反应生成硝酸锌和银,硝酸银反应完后,若还有锌粉,锌才能与硝酸铜反应生成硝酸锌和铜,硝酸铜反应完后,若还有锌粉,锌才能与硝酸亚铁反应生成硝酸锌和铁。由题图可知,反应过程中依次发生了上述3个反应。
c点时,锌与硝酸铜恰好完全反应,则对应溶液中含有的金属离子为$Zn^{2+}$和$Fe^{2+}$,A错误;b~c段(不含两端点)析出的金属是铜,B错误;a~b段(不含两端点)发生的是锌与硝酸银的反应,至b点恰好完全反应,则对应溶液中含有的金属离子为$Zn^{2+}$、$Ag^{+}$、$Cu^{2+}$、$Fe^{2+}$,C正确;b~c段和c~d段发生的反应分别是$Zn+Cu(NO_{3})_{2}=Zn(NO_{3})_{2}+Cu$、$Zn+Fe(NO_{3})_{2}=Zn(NO_{3})_{2}+Fe$,每65份质量的锌可置换出64份质量的铜,每65份质量的锌可置换出56份质量的铁,若b~c段和c~d段中析出固体的质量相等,设为x,参加反应的锌粉质量分别为$m_{1}$和$m_{2}$,则$m_{1}=\frac{65}{64}x$,$m_{2}=\frac{65}{56}x$,$m_{1}<m_{2}$,D错误。
c点时,锌与硝酸铜恰好完全反应,则对应溶液中含有的金属离子为$Zn^{2+}$和$Fe^{2+}$,A错误;b~c段(不含两端点)析出的金属是铜,B错误;a~b段(不含两端点)发生的是锌与硝酸银的反应,至b点恰好完全反应,则对应溶液中含有的金属离子为$Zn^{2+}$、$Ag^{+}$、$Cu^{2+}$、$Fe^{2+}$,C正确;b~c段和c~d段发生的反应分别是$Zn+Cu(NO_{3})_{2}=Zn(NO_{3})_{2}+Cu$、$Zn+Fe(NO_{3})_{2}=Zn(NO_{3})_{2}+Fe$,每65份质量的锌可置换出64份质量的铜,每65份质量的锌可置换出56份质量的铁,若b~c段和c~d段中析出固体的质量相等,设为x,参加反应的锌粉质量分别为$m_{1}$和$m_{2}$,则$m_{1}=\frac{65}{64}x$,$m_{2}=\frac{65}{56}x$,$m_{1}<m_{2}$,D错误。
15. 在已调平的天平两端各放一个等质量的烧杯,向烧杯中各注入质量相等、溶质质量分数也相等的足量稀硫酸。在左边烧杯中投入一定质量的金属$X$粉末,同时在右边烧杯中投入与$X$等质量的金属$Y$粉末。观察到天平的指针先偏向左边,当两种金属完全反应后,天平的指针偏向右边,则$X$、$Y$是下表组合中的(

D
)
答案:
15.D 【解析】开始时天平的指针先偏向左边,说明天平左边质量减小得较慢,即Y与酸反应比X剧烈,金属Y的活动性比X强;金属Mg、Fe、Zn的活动性从强到弱的顺序为$Mg>Zn>Fe$;天平的指针最后偏向右边,说明到反应结束时左边产生气体较多,即等质量的金属完全反应,Y产生氢气的质量小于X;Mg、Fe、Zn与稀硫酸反应后的化合价相同,根据“氢气的质量=$\frac{金属化合价}{金属相对原子质量}×金属质量$”可知,等质量的Mg、Fe、Zn与足量的稀硫酸完全反应,产生氢气的质量从大到小的顺序为$Mg>Fe>Zn$;综上所述,D符合题意。
16. (6 分)
(1)用铁锅烧菜是利用了铁的
(2)在日常生活、工农业生产和科学研究中,大量使用的金属材料常常不是纯金属,而是它们的合金,原因是:①合金的硬度比纯金属
(1)用铁锅烧菜是利用了铁的
导热
性;铁可以拉丝、压成片是利用了铁的延展
性;油罐车内的石油由于振荡可产生静电,容易引起火灾,所以在油罐车的尾部常见一条拖地的铁链,这是利用了铁的导电
性。(2)在日常生活、工农业生产和科学研究中,大量使用的金属材料常常不是纯金属,而是它们的合金,原因是:①合金的硬度比纯金属
大
(填“大”或“小”);②合金的熔点比纯金属低
(填“高”或“低”);③合金的抗腐蚀性能比纯金属强
(填“强”或“弱”)。
答案:
16.
(1)导热 延展 导电
(2)大 低 强
(1)导热 延展 导电
(2)大 低 强
17. (8 分)金属是一类重要的材料,研究其性质十分必要。
(1)人们习惯上称为“五金”的金、银、铜、铁、锡中,把金属
(2)“真金不怕火炼”说明金的
(3)下面是某小组同学关于金属镁和铁的性质的对比研究。
在室温条件下进行以下实验:试管内的镁和铁表面均被打磨过,且形状、大小均相同,向两支试管中同时加入相同质量的稀盐酸,可观察到单位时间内
(1)人们习惯上称为“五金”的金、银、铜、铁、锡中,把金属
Fe
(填元素符号)的位置移到最后,正好符合金属活动性由弱到强
(填“由强到弱”或“由弱到强”)的顺序,其中可以和稀硫酸发生化学反应的金属是铁、锡(或Fe、Sn)
。(2)“真金不怕火炼”说明金的
化学性质不活泼(或化学性质稳定)
;鉴别黄金和黄铜(铜、锌合金)可以使用的方法是加入稀硫酸,观察表面是否产生气泡(合理即可)
。(3)下面是某小组同学关于金属镁和铁的性质的对比研究。
在室温条件下进行以下实验:试管内的镁和铁表面均被打磨过,且形状、大小均相同,向两支试管中同时加入相同质量的稀盐酸,可观察到单位时间内
镁
(填“镁”或“铁”)产生的气泡较多,可得出的结论是:金属活动性Mg
(填元素符号,下同)$>$Fe
。
答案:
17.
(1)Fe 由弱到强 铁、锡(或Fe、Sn)
(2)化学性质不活泼(或化学性质稳定) 加入稀硫酸,观察表面是否产生气泡(合理即可)
(3)镁 Mg Fe
(1)Fe 由弱到强 铁、锡(或Fe、Sn)
(2)化学性质不活泼(或化学性质稳定) 加入稀硫酸,观察表面是否产生气泡(合理即可)
(3)镁 Mg Fe
查看更多完整答案,请扫码查看


