第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
3. 某同学为了测定石灰石矿石中碳酸钙的质量分数,他将盛有21g石灰石样品的烧杯放在电子台秤上,然后将100g稀盐酸均分为5份,分别加入烧杯中充分反应,每次记录称量烧杯内物质总质量减少的数据,见下表。(反应的化学方程式为$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$)
|次数|第1次|第2次|第3次|第4次|第5次|
|----|----|----|----|----|----|
|稀盐酸/g|20|20|20|20|20|
|烧杯内物质总质量减少/g|2|2|2|m|0.8|
请计算:(1)m=
(2)石灰石样品中碳酸钙的质量分数。(精确到0.1%)
|次数|第1次|第2次|第3次|第4次|第5次|
|----|----|----|----|----|----|
|稀盐酸/g|20|20|20|20|20|
|烧杯内物质总质量减少/g|2|2|2|m|0.8|
请计算:(1)m=
2
g。(2)石灰石样品中碳酸钙的质量分数。(精确到0.1%)
答案:
(1)2
(2)解:产生二氧化碳的总质量为$2g+2g+2g+2g+0.8g=8.8g$;
设石灰石样品中碳酸钙的质量为x。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 44
x 8.8g
$\frac {100}{44}=\frac {x}{8.8g}$ $x=20g$
石灰石样品中碳酸钙的质量分数为$\frac {20g}{21g}×100\% \approx 95.2\%$。
答:石灰石样品中碳酸钙的质量分数为95.2%。
(1)2
(2)解:产生二氧化碳的总质量为$2g+2g+2g+2g+0.8g=8.8g$;
设石灰石样品中碳酸钙的质量为x。
$CaCO_{3}+2HCl=CaCl_{2}+H_{2}O+CO_{2}\uparrow$
100 44
x 8.8g
$\frac {100}{44}=\frac {x}{8.8g}$ $x=20g$
石灰石样品中碳酸钙的质量分数为$\frac {20g}{21g}×100\% \approx 95.2\%$。
答:石灰石样品中碳酸钙的质量分数为95.2%。
4. (2023·广东)羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图1所示。
(1)$Fe(CO)_{5}$中碳、氧元素的质量比为______
(2)反应1的化学方程式为$Fe+5CO\xlongequal{高温}Fe(CO)_{5}$。用100kg含铁96%的海绵铁,理论上可制备$Fe(CO)_{5}$的质量是多少(写出计算过程)?
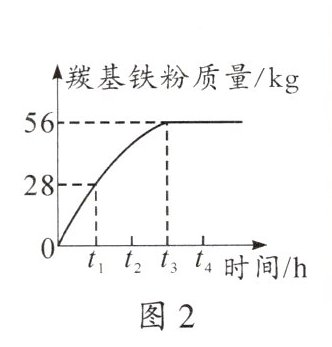
(3)反应2的化学方程式为$Fe(CO)_{5}\xlongequal{一定条件}Fe+5CO\uparrow$。196kg$Fe(CO)_{5}$分解生成羰基铁粉的质量随时间的变化如图2所示。在$t_{1}$时,剩余______
(4)制备羰基铁粉过程中,可循环利用的物质是______
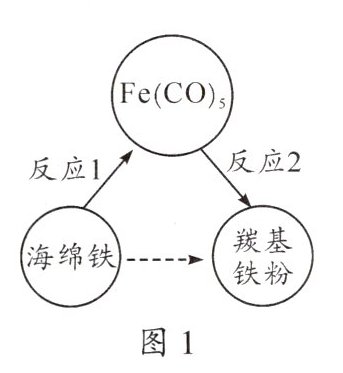
(1)$Fe(CO)_{5}$中碳、氧元素的质量比为______
3:4
。(2)反应1的化学方程式为$Fe+5CO\xlongequal{高温}Fe(CO)_{5}$。用100kg含铁96%的海绵铁,理论上可制备$Fe(CO)_{5}$的质量是多少(写出计算过程)?
(3)反应2的化学方程式为$Fe(CO)_{5}\xlongequal{一定条件}Fe+5CO\uparrow$。196kg$Fe(CO)_{5}$分解生成羰基铁粉的质量随时间的变化如图2所示。在$t_{1}$时,剩余______
98
kg$Fe(CO)_{5}$未分解;在______$t_{3}$
时,$Fe(CO)_{5}$恰好完全分解。(4)制备羰基铁粉过程中,可循环利用的物质是______
CO
。

答案:
(1)$3:4$
(2)解:设可以制备$Fe(CO)_{5}$的质量为x。
$Fe+5CO\xlongequal {高温}Fe(CO)_{5}$
56 196
$100kg×96\%$ x
$\frac {56}{196}=\frac {100kg×96\% }{x}$
$x=336kg$
答:理论上可以制备$Fe(CO)_{5}$的质量为336kg。
(3)98 $t_{3}$
(4)CO
(1)$3:4$
(2)解:设可以制备$Fe(CO)_{5}$的质量为x。
$Fe+5CO\xlongequal {高温}Fe(CO)_{5}$
56 196
$100kg×96\%$ x
$\frac {56}{196}=\frac {100kg×96\% }{x}$
$x=336kg$
答:理论上可以制备$Fe(CO)_{5}$的质量为336kg。
(3)98 $t_{3}$
(4)CO
查看更多完整答案,请扫码查看


