第139页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
金属材料
合金
定义:在纯金属中加热熔合某些①
铁合金:生铁(含碳2%~4.3%)、钢(含碳0.03%~2%)
优点:合金的强度和硬度一般比纯金属更③
纯金属
物理性质:都具有金属光泽,一般都有导电性、导热性和延展性,熔点较高,硬度和密度比较大,常温下除⑤
金属和金属材料
金属的性质
化学性质
与氧气反应
常温下,铝能与氧气反应:⑥
加热时,铜能与氧气反应:⑦
金在点燃或加热时都不能与氧气反应,说明⑧
与酸反应(⑨
Mg+2HCl=MgCl₂+H₂↑、Mg+H₂SO₄=MgSO₄+H₂↑
Zn+2HCl=ZnCl₂+H₂↑、Zn+H₂SO₄=ZnSO₄+H₂↑
Fe+2HCl=FeCl₂+H₂↑、Fe+H₂SO₄=FeSO₄+H₂↑
与金属化合物溶液反应(置换反应)
铁与硫酸铜溶液反应(溶液由⑩
铜与硝酸银溶液反应:⑬
金属活动性顺序
K ⑭
金属活动性由强逐渐减弱
判断依据:越在前面越活泼,氢前金属置换氢,前金属置换后金属
铁的冶炼
原料:赤铁矿石、焦炭、石灰石、空气
原理:⑲
焦炭的作用
(1)⑳
(2)㉑
金属资源保护
铁生锈的条件:铁与空气中的㉒
防止铁生锈的措施
①保持铁制品表面清洁干燥;②在铁制品表面涂保护膜;
③在铁制品表面镀其他金属;④在铁里面熔入其他金属制成合金
保护金属资源的途径
①防止金属的腐蚀;②回收利用金属
③有计划、合理地开采矿物;④寻找金属的代用品
合金
定义:在纯金属中加热熔合某些①
金属或非金属
而得到的具有金属特征的物质,合金属于②混合物
铁合金:生铁(含碳2%~4.3%)、钢(含碳0.03%~2%)
优点:合金的强度和硬度一般比纯金属更③
高
,熔点更④低
,抗腐蚀性能更好纯金属
物理性质:都具有金属光泽,一般都有导电性、导热性和延展性,熔点较高,硬度和密度比较大,常温下除⑤
汞
外都是固体金属和金属材料
金属的性质
化学性质
与氧气反应
常温下,铝能与氧气反应:⑥
$4Al + 3O_{2} = 2Al_{2}O_{3}$
加热时,铜能与氧气反应:⑦
$2Cu + O_{2}\xlongequal{\triangle}2CuO$
金在点燃或加热时都不能与氧气反应,说明⑧
金的化学性质很稳定
与酸反应(⑨
置换
反应)Mg+2HCl=MgCl₂+H₂↑、Mg+H₂SO₄=MgSO₄+H₂↑
Zn+2HCl=ZnCl₂+H₂↑、Zn+H₂SO₄=ZnSO₄+H₂↑
Fe+2HCl=FeCl₂+H₂↑、Fe+H₂SO₄=FeSO₄+H₂↑
与金属化合物溶液反应(置换反应)
铁与硫酸铜溶液反应(溶液由⑩
蓝
色变成⑪浅绿
色,铁丝表面有⑫红
色固体析出):Fe+CuSO₄=FeSO₄+Cu铜与硝酸银溶液反应:⑬
$Cu + 2AgNO_{3} = 2Ag + Cu(NO_{3})_{2}$
金属活动性顺序
K ⑭
Ca
Na ⑮Mg
⑯Al
Zn ⑰Fe
Sn Pb(H) ⑱Cu
Hg Ag Pt Au金属活动性由强逐渐减弱
判断依据:越在前面越活泼,氢前金属置换氢,前金属置换后金属
铁的冶炼
原料:赤铁矿石、焦炭、石灰石、空气
原理:⑲
$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$
(写化学方程式)焦炭的作用
(1)⑳
$C + O_{2}\xlongequal{点燃}CO_{2}$
(提供热量)(写化学议程式,下同)(2)㉑
$C + CO_{2}\xlongequal{高温}2CO$
(提供还原剂)金属资源保护
铁生锈的条件:铁与空气中的㉒
氧气
和㉓水蒸气
同时接触防止铁生锈的措施
①保持铁制品表面清洁干燥;②在铁制品表面涂保护膜;
③在铁制品表面镀其他金属;④在铁里面熔入其他金属制成合金
保护金属资源的途径
①防止金属的腐蚀;②回收利用金属
③有计划、合理地开采矿物;④寻找金属的代用品
答案:
①金属或非金属 ②混合物
③高 ④低 ⑤汞
⑥$4Al + 3O_{2} = 2Al_{2}O_{3}$
⑦$2Cu + O_{2}\xlongequal{\triangle}2CuO$
⑧金的化学性质很稳定
⑨置换 ⑩蓝 ⑪浅绿
⑫红 ⑬$Cu + 2AgNO_{3} = 2Ag + Cu(NO_{3})_{2}$ ⑭Ca ⑮Mg
⑯Al ⑰Fe ⑱Cu
⑲$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$
⑳$C + O_{2}\xlongequal{点燃}CO_{2}$
㉑$C + CO_{2}\xlongequal{高温}2CO$
㉒氧气 ㉓水蒸气
③高 ④低 ⑤汞
⑥$4Al + 3O_{2} = 2Al_{2}O_{3}$
⑦$2Cu + O_{2}\xlongequal{\triangle}2CuO$
⑧金的化学性质很稳定
⑨置换 ⑩蓝 ⑪浅绿
⑫红 ⑬$Cu + 2AgNO_{3} = 2Ag + Cu(NO_{3})_{2}$ ⑭Ca ⑮Mg
⑯Al ⑰Fe ⑱Cu
⑲$3CO + Fe_{2}O_{3}\xlongequal{高温}2Fe + 3CO_{2}$
⑳$C + O_{2}\xlongequal{点燃}CO_{2}$
㉑$C + CO_{2}\xlongequal{高温}2CO$
㉒氧气 ㉓水蒸气
1. 金属铁的反应或转化(如图1所示):
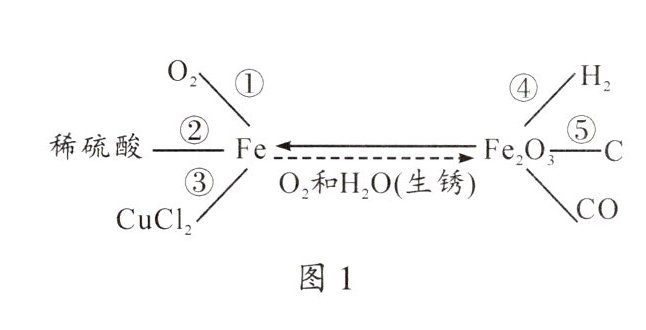
①
②
③
④
⑤

①
$3Fe + 2O_{2}\xlongequal{点燃}Fe_{3}O_{4}$
②
$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
③
$Fe + CuCl_{2} = FeCl_{2} + Cu$
④
$Fe_{2}O_{3} + 3H_{2}\xlongequal{高温}2Fe + 3H_{2}O$
⑤
$2Fe_{2}O_{3} + 3C\xlongequal{高温}4Fe + 3CO_{2}\uparrow$
答案:
1. ①$3Fe + 2O_{2}\xlongequal{点燃}Fe_{3}O_{4}$
②$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
③$Fe + CuCl_{2} = FeCl_{2} + Cu$
④$Fe_{2}O_{3} + 3H_{2}\xlongequal{高温}2Fe + 3H_{2}O$
⑤$2Fe_{2}O_{3} + 3C\xlongequal{高温}4Fe + 3CO_{2}\uparrow$
②$Fe + H_{2}SO_{4} = FeSO_{4} + H_{2}\uparrow$
③$Fe + CuCl_{2} = FeCl_{2} + Cu$
④$Fe_{2}O_{3} + 3H_{2}\xlongequal{高温}2Fe + 3H_{2}O$
⑤$2Fe_{2}O_{3} + 3C\xlongequal{高温}4Fe + 3CO_{2}\uparrow$
查看更多完整答案,请扫码查看


