2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第91页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
2. 工业合成氨的适宜条件

特别提醒 生产过程中,原料气必须净化,目的是防止催化剂“中毒”。

特别提醒 生产过程中,原料气必须净化,目的是防止催化剂“中毒”。
答案:
2.$10^7~10^8 Pa$ 增大反应速率 促进平衡正向移动,提高氨的产率和反应物的转化率 压强过大,设备投资将大幅增加 700 K 提高化学反应速率 催化剂活性最大 铁 提高化学反应速率 氨循环使用 $ N_2$和$ H_2$ 提高氨的产率和原料利用率
1. 在合成氨中,为增加 ${H_{2}}$ 的转化率,充入的 ${N_{2}}$ 越多越好。 (
2. 使气态氨变成液氨后及时从平衡混合物中分离出去,可提高原料的利用率。 (
3. 合成氨反应选择在 $700\ K$ 左右进行的重要原因是催化剂在 $700\ K$ 左右时的活性最大。 (
4. 一个化工生产的过程中只考虑反应的限度问题即可。 (
×
)2. 使气态氨变成液氨后及时从平衡混合物中分离出去,可提高原料的利用率。 (
√
)3. 合成氨反应选择在 $700\ K$ 左右进行的重要原因是催化剂在 $700\ K$ 左右时的活性最大。 (
√
)4. 一个化工生产的过程中只考虑反应的限度问题即可。 (
×
)
答案:
1.× 2.√ 3.√ 4.×
合成氨的反应中,为何将氮气、氢气的投料比定为 $1:2.8$ 呢?
提示:温度、压强一定时,$ N_2$与$ H_2$的体积比为1∶3时,平衡混合物中氨的含量最高;根据在特定条件下,$v = kc( N_2) · c^{1.5}( H_2) · c^{-1}( NH_3)$,提高$ H_2$的压强似乎更有利于提高合成氨反应的速率,但是,$ N_2$在催化剂上的吸附分解为总反应中最慢的步骤,即这是影响反应速率的关键步骤。实验表明,适当提高$ N_2$的比例,当$ N_2$与$ H_2$的物质的量之比为1∶2.8时更能加快合成氨反应的进行。
答案:
提示:温度、压强一定时,$ N_2$与$ H_2$的体积比为1∶3时,平衡混合物中氨的含量最高;根据在特定条件下,$v = kc( N_2) · c^{1.5}( H_2) · c^{-1}( NH_3)$,提高$ H_2$的压强似乎更有利于提高合成氨反应的速率,但是,$ N_2$在催化剂上的吸附分解为总反应中最慢的步骤,即这是影响反应速率的关键步骤。实验表明,适当提高$ N_2$的比例,当$ N_2$与$ H_2$的物质的量之比为1∶2.8时更能加快合成氨反应的进行。
1. 化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下列哪项不是其主要目的 (
A.节约原料和能源
B.提高产品的产量
C.提高经济效益
D.提高化学反应速率
D
)A.节约原料和能源
B.提高产品的产量
C.提高经济效益
D.提高化学反应速率
答案:
1.D 提高化学反应的限度,可使更多的反应物转化为生成物,提高产品的产量,提高原料的利用率,从而提高经济效益,但不一定能提高化学反应速率。
2. (2024·江苏苏州高二检测) ${NH_{3}}$ 是重要的化工原料,合成氨反应为 ${N_{2}(g) + 3H_{2}(g)⇌ 2NH_{3}(g)}$ $\Delta H = -92.4\ {kJ· mol^{-1}}$。工业上常用氨氧化法制硝酸 (如图):将氨和空气混合后先经过热交换器,再通入灼热催化剂铂铑合金网生成 $NO$,经过反应 ${2NO(g) + O_{2}(g)\xlongequal{}2NO_{2}(g)}$ $\Delta H = -116.4\ {kJ· mol^{-1}}$,将 ${NO_{2}}$ 与水反应制得硝酸。
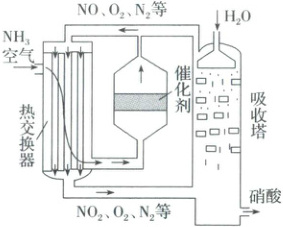
下列有关合成氨工业和硝酸工业的说法正确的是 (
A.合成氨工业中可用空气代替 ${N_{2}}$ 作原料
B.硝酸工业的尾气可以直接排放
C.催化剂铂铑合金网同时降低了正、逆反应的活化能
D.经过热交换器后,反应 ${2NO + O_{2}\xlongequal{}2NO_{2}}$ 中的 $NO$ 转化率降低

下列有关合成氨工业和硝酸工业的说法正确的是 (
C
)A.合成氨工业中可用空气代替 ${N_{2}}$ 作原料
B.硝酸工业的尾气可以直接排放
C.催化剂铂铑合金网同时降低了正、逆反应的活化能
D.经过热交换器后,反应 ${2NO + O_{2}\xlongequal{}2NO_{2}}$ 中的 $NO$ 转化率降低
答案:
2.C 空气中含氧气,与氢气混合加热时会发生爆炸,则合成氨工业中不可用空气代替$ N_2$作原料,A错误;氮氧化物有毒、会污染空气,硝酸工业的尾气不可以直接排放,B错误;催化剂铂铑合金网能使正、逆反应速率增大同等幅度,因为催化剂能同时降低正、逆反应的活化能,C正确;由题干和图可知,氨和空气的混合气体经过热交换器后升温、再通入灼热催化剂铂铑合金网生成NO,而一氧化氮、氧气和氮气的混合气体经过热交换器后,混合气体降温,则反应$2 NO + O_2 \rightleftharpoons 2 NO_2$朝放热方向即正反应移动,故$2 NO + O_2 \rightleftharpoons 2 NO_2$中NO的转化率增大,D错误。
查看更多完整答案,请扫码查看


