2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第48页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
1.(2023·广东卷,节选)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值 Q 可通过量热装置测量反应前后体系温度的变化,用公式$Q = c\rho V_总 · \Delta T$计算获得。
(1)热量的测定:取$0.5000mol· L^{-1}NaOH$溶液和$0.5500mol· L^{-1}$盐酸各$50mL$进行反应,测得反应前后体系的温度值($° C$)分别为$T_0$、$T_1$,则该过程放出的热量为
(2)借鉴(1)的方法,甲同学测量放热反应$Fe(s)+CuSO_4(aq)\longrightarrow FeSO_4(aq)+Cu(s)$的焓变$\Delta H$(忽略温度对焓变的影响)。实验结果如表所示。

①温度:$b$
②$\Delta H=$
结果表明,该方法可行。
(1)热量的测定:取$0.5000mol· L^{-1}NaOH$溶液和$0.5500mol· L^{-1}$盐酸各$50mL$进行反应,测得反应前后体系的温度值($° C$)分别为$T_0$、$T_1$,则该过程放出的热量为
418(T₁-T₀)
$J(c$和$\rho$分别取$4.18J· g^{-1}· ° C^{-1}$和$1.0g· mL^{-1}$,忽略水以外各物质吸收的热量,下同)。(2)借鉴(1)的方法,甲同学测量放热反应$Fe(s)+CuSO_4(aq)\longrightarrow FeSO_4(aq)+Cu(s)$的焓变$\Delta H$(忽略温度对焓变的影响)。实验结果如表所示。

①温度:$b$
>
(填“>”“<”或“=”)$c$。②$\Delta H=$
-20.9(b-a)kJ·mol⁻¹[或-41.8(c-a)kJ·mol⁻¹]
(选择表中一组数据计算)。结果表明,该方法可行。
答案:
1.答案:
(1)418(T₁-T₀)
(2)①> ②-20.9(b-a)kJ·mol⁻¹[或-41.8(c-a)kJ·mol⁻¹]
解析:
(1)由Q=cρV总·ΔT可得Q=4.18J·g⁻¹·℃⁻¹×1.0g·mL⁻¹×(50mL + 50mL)×(T₁-T₀)℃=418(T₁-T₀)J。
(2)100mL0.20mol·L⁻¹CuSO₄溶液中含有溶质的物质的量为0.02mol,1.20gFe粉的物质的量约为0.021mol,0.56gFe粉的物质的量为0.01mol,实验ⅰ中有0.02molCuSO₄发生反应,实验ⅱ中有0.01molCuSO₄发生反应,实验ⅰ放出的热量多,则b>c;若按实验ⅰ进行计算,ΔH = $\frac{4.18×1.0×100×(b - a)}{1000×0.02}$kJ·mol⁻¹ = -20.9(b - a)kJ·mol⁻¹;若按实验ⅱ进行计算,ΔH = $\frac{4.18×1.0×100×(c - a)}{1000×0.01}$kJ·mol⁻¹ = -41.8(c - a)kJ·mol⁻¹。
(1)418(T₁-T₀)
(2)①> ②-20.9(b-a)kJ·mol⁻¹[或-41.8(c-a)kJ·mol⁻¹]
解析:
(1)由Q=cρV总·ΔT可得Q=4.18J·g⁻¹·℃⁻¹×1.0g·mL⁻¹×(50mL + 50mL)×(T₁-T₀)℃=418(T₁-T₀)J。
(2)100mL0.20mol·L⁻¹CuSO₄溶液中含有溶质的物质的量为0.02mol,1.20gFe粉的物质的量约为0.021mol,0.56gFe粉的物质的量为0.01mol,实验ⅰ中有0.02molCuSO₄发生反应,实验ⅱ中有0.01molCuSO₄发生反应,实验ⅰ放出的热量多,则b>c;若按实验ⅰ进行计算,ΔH = $\frac{4.18×1.0×100×(b - a)}{1000×0.02}$kJ·mol⁻¹ = -20.9(b - a)kJ·mol⁻¹;若按实验ⅱ进行计算,ΔH = $\frac{4.18×1.0×100×(c - a)}{1000×0.01}$kJ·mol⁻¹ = -41.8(c - a)kJ·mol⁻¹。
2.(2023·新课标卷,节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
根据图中数据计算反应$\frac{1}{2}N_2(g)+\frac{3}{2}H_2(g)\rightleftharpoons NH_3(g)$的$\Delta H=$
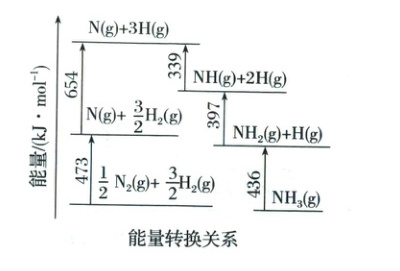
根据图中数据计算反应$\frac{1}{2}N_2(g)+\frac{3}{2}H_2(g)\rightleftharpoons NH_3(g)$的$\Delta H=$
-45
$kJ· mol^{-1}$。
答案:
2.答案:-45
解析:该反应的ΔH = 断裂旧键吸收的总能量—形成新键释放的总能量=(473 + 654)kJ·mol⁻¹ - (339 + 397 + 436)kJ·mol⁻¹ = -45kJ·mol⁻¹。
解析:该反应的ΔH = 断裂旧键吸收的总能量—形成新键释放的总能量=(473 + 654)kJ·mol⁻¹ - (339 + 397 + 436)kJ·mol⁻¹ = -45kJ·mol⁻¹。
3.(2023·湖南卷,节选)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
苯乙烯的制备
已知下列反应的热化学方程式:
①$C_6H_5C_2H_5(g)+\frac{21}{2}O_2(g)\longrightarrow 8CO_2(g)+5H_2O(g)\ \ \Delta H_1 = -4386.9kJ· mol^{-1}$
②$C_6H_5CH=CH_2(g)+10O_2(g)\longrightarrow 8CO_2(g)+4H_2O(g)\ \ \Delta H_2 = -4263.1kJ· mol^{-1}$
③$H_2(g)+\frac{1}{2}O_2(g)\longrightarrow H_2O(g)\ \ \Delta H_3 = -241.8kJ· mol^{-1}$
计算反应④$C_6H_5C_2H_5(g)\rightleftharpoons C_6H_5CH=CH_2(g)+H_2(g)$的$\Delta H_4=$
苯乙烯的制备
已知下列反应的热化学方程式:
①$C_6H_5C_2H_5(g)+\frac{21}{2}O_2(g)\longrightarrow 8CO_2(g)+5H_2O(g)\ \ \Delta H_1 = -4386.9kJ· mol^{-1}$
②$C_6H_5CH=CH_2(g)+10O_2(g)\longrightarrow 8CO_2(g)+4H_2O(g)\ \ \Delta H_2 = -4263.1kJ· mol^{-1}$
③$H_2(g)+\frac{1}{2}O_2(g)\longrightarrow H_2O(g)\ \ \Delta H_3 = -241.8kJ· mol^{-1}$
计算反应④$C_6H_5C_2H_5(g)\rightleftharpoons C_6H_5CH=CH_2(g)+H_2(g)$的$\Delta H_4=$
+118
$kJ· mol^{-1}$。
答案:
3.答案:+118
解析:根据盖斯定律,由① - ② - ③可得④,则ΔH₄ = -4386.9kJ·mol⁻¹ - (-4263.1kJ·mol⁻¹) - (-241.8kJ·mol⁻¹) = +118kJ·mol⁻¹。
解析:根据盖斯定律,由① - ② - ③可得④,则ΔH₄ = -4386.9kJ·mol⁻¹ - (-4263.1kJ·mol⁻¹) - (-241.8kJ·mol⁻¹) = +118kJ·mol⁻¹。
查看更多完整答案,请扫码查看


