2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第85页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
1. ${2SO_{2}(g) + O_{2}(g)⇌ 2SO_{3}(g)}$反应进程中能量变化如图所示(图中$E_{1}$表示正反应的活化能,$E_{2}$表示逆反应的活化能)。下列有关叙述正确的是 (
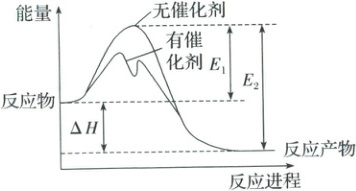
A.$\Delta H = E_{1} - E_{2}$
B.该反应为吸热反应
C.升高温度,不影响活化分子百分数
D.使用催化剂使该反应的反应热发生改变
A
)
A.$\Delta H = E_{1} - E_{2}$
B.该反应为吸热反应
C.升高温度,不影响活化分子百分数
D.使用催化剂使该反应的反应热发生改变
答案:
A $\Delta H =$正反应的活化能—逆反应的活化能$= E_1 - E_2$,A项正确;
由图像可知反应物的总能量高于反应产物的总能量,该反应是放热反应,B项错误;升高温度,活化分子百分数增加,所以反应速率增大,C项错误;催化剂不能改变反应的始态和终态的能量,只能改变反应途径及活化能,则对反应的反应热无影响,D项错误。
由图像可知反应物的总能量高于反应产物的总能量,该反应是放热反应,B项错误;升高温度,活化分子百分数增加,所以反应速率增大,C项错误;催化剂不能改变反应的始态和终态的能量,只能改变反应途径及活化能,则对反应的反应热无影响,D项错误。
2. 在有气体参与的反应中,①增大反应物浓度、②升高温度、③增大压强(压缩体积)、④加入催化剂,若以上四种方法均可使反应速率增大,完成下列问题(填序号):
(1)降低反应活化能的是
(2)增加活化分子百分数的是
(3)未改变活化分子百分数,增加单位体积内分子总数的是
(4)增加单位体积内活化分子数的是
(1)降低反应活化能的是
④
。(2)增加活化分子百分数的是
②④
。(3)未改变活化分子百分数,增加单位体积内分子总数的是
①③
。(4)增加单位体积内活化分子数的是
①②③④
。
答案:
(1)④
(2)②④
(3)①③
(4)①②③④
(1)④
(2)②④
(3)①③
(4)①②③④
1. 已知反应:${2NO(g) + Br_{2}(g)⇌ 2NOBr(g)}$ $\Delta H = -a\ kJ· mol^{-1}(a > 0)$,其反应机理如下:
①${NO(g) + Br_{2}(g)⇌ NOBr_{2}(g)}$ 快;
②${NO(g) + NOBr_{2}(g)⇌ 2NOBr(g)}$ 慢。
下列有关该反应的说法正确的是 (
A.该反应的速率主要取决于①的快慢
B.${NOBr_{2}}$是该反应的催化剂
C.正反应的活化能比逆反应的活化能小$a\ kJ· mol^{-1}$
D.增大${Br_{2}(g)}$的浓度能增大活化分子百分数,加快反应速率
①${NO(g) + Br_{2}(g)⇌ NOBr_{2}(g)}$ 快;
②${NO(g) + NOBr_{2}(g)⇌ 2NOBr(g)}$ 慢。
下列有关该反应的说法正确的是 (
C
)A.该反应的速率主要取决于①的快慢
B.${NOBr_{2}}$是该反应的催化剂
C.正反应的活化能比逆反应的活化能小$a\ kJ· mol^{-1}$
D.增大${Br_{2}(g)}$的浓度能增大活化分子百分数,加快反应速率
答案:
C 反应速率主要取决于慢的一步,所以该反应的速率主要取决于
②的快慢,故A错误;$\mathrm{NOBr_2}$是反应过程中的中间产物,不是该反应的催化剂,故B错误;由于该反应为放热反应,说明反应物的总能量高于生成物的总能量,所以正反应的活化能比逆反应的活化能小$a\ \mathrm{kJ · mol^{-1}}$,故C正确;增大$\mathrm{Br_2(g)}$浓度,活化分子百分数不变,但单位体积内的活化分子数目增多,所以能加快反应速率,故D错误。
②的快慢,故A错误;$\mathrm{NOBr_2}$是反应过程中的中间产物,不是该反应的催化剂,故B错误;由于该反应为放热反应,说明反应物的总能量高于生成物的总能量,所以正反应的活化能比逆反应的活化能小$a\ \mathrm{kJ · mol^{-1}}$,故C正确;增大$\mathrm{Br_2(g)}$浓度,活化分子百分数不变,但单位体积内的活化分子数目增多,所以能加快反应速率,故D错误。
2. 二氧化碳选择性加氢制甲醇是解决温室效应、发展绿色能源和实现经济可持续发展的重要途径之一。常温常压下利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催化剂表面上的粒子用$*$标注),下列说法错误的是 (
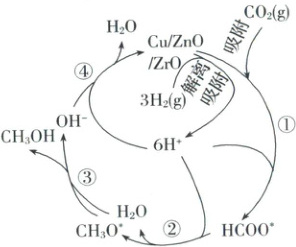
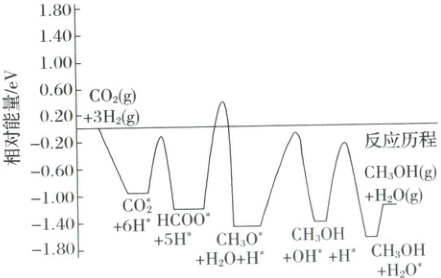
A.催化剂能改变反应机理,加快反应速率,降低反应热
B.二氧化碳选择性加氢制甲醇是放热反应
C.该历程的决速步骤为${HCOO^{*} + 4H^{+} = CH_{3}O^{*} + H_{2}O}$
D.总反应为${CO_{2}(g) + 3H_{2}(g) = CH_{3}OH(g) + H_{2}O(g)}$
A
)

A.催化剂能改变反应机理,加快反应速率,降低反应热
B.二氧化碳选择性加氢制甲醇是放热反应
C.该历程的决速步骤为${HCOO^{*} + 4H^{+} = CH_{3}O^{*} + H_{2}O}$
D.总反应为${CO_{2}(g) + 3H_{2}(g) = CH_{3}OH(g) + H_{2}O(g)}$
答案:
A 催化剂能改变反应机理,加快反应速率,不能改变反应热,选项A错误;由反应历程图可知反应物的总能量大于生成物的总能量,该反应为放热反应,选项B正确;由反应历程图可知,$\mathrm{HCOO^*} + 4\mathrm{H^*} + \mathrm{e^-} = \mathrm{CH_3O^*} + \mathrm{H_2O}$的活化能最大,是该历程的决速步骤,选项C正确;该反应的反应物是$\mathrm{CO_2}$和$\mathrm{H_2}$,生成物是$\mathrm{CH_3OH}$和$\mathrm{H_2O}$,则总反应为$\mathrm{CO_2(g)} + 3\mathrm{H_2(g)} = \mathrm{CH_3OH(g)} + \mathrm{H_2O(g)}$,选项D正确。
查看更多完整答案,请扫码查看


