2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第43页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
二、“神舟”飞船中的电池
1. 当飞船进入光照区时,太阳能电池为用电设备供电,同时为镍镉电池充电,此时,镍镉电池的电极反应为
负极:
正极:$2\mathrm{Ni(OH)_2} + 2\mathrm{OH^-} - 2\mathrm{e^-} \longrightarrow 2\mathrm{NiOOH} + 2\mathrm{H_2O}$
$\mathrm{NiOOH}$常称为氢氧化氧镍或碱式氧化镍,其中镍为+3 价。
2. 当飞船进入阴影区时,由镍镉电池提供电能,此时,电极反应为
负极:
正极:$2\mathrm{NiOOH} + 2\mathrm{H_2O} + 2\mathrm{e^-} \longrightarrow 2\mathrm{Ni(OH)_2} + 2\mathrm{OH^-}$。
1. 当飞船进入光照区时,太阳能电池为用电设备供电,同时为镍镉电池充电,此时,镍镉电池的电极反应为
负极:
$\mathrm{Cd(OH)_2}+2\mathrm{e^-}=\mathrm{Cd}+2\mathrm{OH^-}$
;正极:$2\mathrm{Ni(OH)_2} + 2\mathrm{OH^-} - 2\mathrm{e^-} \longrightarrow 2\mathrm{NiOOH} + 2\mathrm{H_2O}$
$\mathrm{NiOOH}$常称为氢氧化氧镍或碱式氧化镍,其中镍为+3 价。
2. 当飞船进入阴影区时,由镍镉电池提供电能,此时,电极反应为
负极:
$\mathrm{Cd}+2\mathrm{OH^-}-2\mathrm{e^-}=\mathrm{Cd(OH)_2}$
;正极:$2\mathrm{NiOOH} + 2\mathrm{H_2O} + 2\mathrm{e^-} \longrightarrow 2\mathrm{Ni(OH)_2} + 2\mathrm{OH^-}$。
答案:
1.$\mathrm{Cd(OH)_2}+2\mathrm{e^-}=\mathrm{Cd}+2\mathrm{OH^-}$
2.$\mathrm{Cd}+2\mathrm{OH^-}-2\mathrm{e^-}=\mathrm{Cd(OH)_2}$
2.$\mathrm{Cd}+2\mathrm{OH^-}-2\mathrm{e^-}=\mathrm{Cd(OH)_2}$
1. 航天飞船的能量部分来自太阳能电池,另外内部还配有高效的 MCFC 型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为$2\mathrm{H_2} + \mathrm{O_2} \longrightarrow 2\mathrm{H_2O}$,负极反应为$\mathrm{H_2} + \mathrm{CO_3^{2-}} - 2\mathrm{e^-} \longrightarrow \mathrm{CO_2} + \mathrm{H_2O}$,则下列推断正确的是
(
A.电池工作时,$\mathrm{CO_3^{2-}}$向负极移动
B.电池放电时,电子由通氧气的正极经外电路流向通氢气的负极
C.正极的电极反应为$4\mathrm{OH^-} - 4\mathrm{e^-} \longrightarrow \mathrm{O_2} \uparrow + 2\mathrm{H_2O}$
D.通氧气的电极发生氧化反应
(
A
)A.电池工作时,$\mathrm{CO_3^{2-}}$向负极移动
B.电池放电时,电子由通氧气的正极经外电路流向通氢气的负极
C.正极的电极反应为$4\mathrm{OH^-} - 4\mathrm{e^-} \longrightarrow \mathrm{O_2} \uparrow + 2\mathrm{H_2O}$
D.通氧气的电极发生氧化反应
答案:
1.A 原电池工作时,阴离子移向负极,电子由负极经外电路流向正极,A项正确,B项错误;通氧气的电极为正极,发生还原反应,电极反应为$\mathrm{O_2}+4\mathrm{e^-}+2\mathrm{CO_2}=2\mathrm{CO_3^{2-}}$,C、D项错误。
2. (2023·北京房山区高二检测)我国神舟系列载人飞船成功进入太空,其电力系统主要由太阳能电池和储能电池构成。据悉,储能电池采用“镍镉蓄电池组”,电池总反应:$\mathrm{Cd} + 2\mathrm{NiOOH} + 2\mathrm{H_2O} \underset{ 充电}{\overset{ 放电}{\rightleftharpoons}} \mathrm{Cd(OH)_2} + 2\mathrm{Ni(OH)_2}$。
下列说法不正确的是
(

A.当飞船进入光照区时,太阳能电池可为镍镉电池充电
B.镍镉电池放电时负极反应:$\mathrm{Cd} - 2\mathrm{e^-} + 2\mathrm{OH^-} \longrightarrow \mathrm{Cd(OH)_2}$
C.镍镉电池充电时阳极反应:$\mathrm{Ni(OH)_2} - \mathrm{e^-} + \mathrm{OH^-} \longrightarrow \mathrm{NiOOH} + \mathrm{H_2O}$
D.镍镉电池充电时电解质溶液中的$\mathrm{OH^-}$移向镉电极
下列说法不正确的是
(
D
)
A.当飞船进入光照区时,太阳能电池可为镍镉电池充电
B.镍镉电池放电时负极反应:$\mathrm{Cd} - 2\mathrm{e^-} + 2\mathrm{OH^-} \longrightarrow \mathrm{Cd(OH)_2}$
C.镍镉电池充电时阳极反应:$\mathrm{Ni(OH)_2} - \mathrm{e^-} + \mathrm{OH^-} \longrightarrow \mathrm{NiOOH} + \mathrm{H_2O}$
D.镍镉电池充电时电解质溶液中的$\mathrm{OH^-}$移向镉电极
答案:
2.D 由题给电池总反应:$\mathrm{Cd}+2\mathrm{NiOOH}+2\mathrm{H_2O}\overset{放电}{\underset{充电}{\rightleftharpoons}}\mathrm{Cd(OH)_2}+2\mathrm{Ni(OH)_2}$知,放电时$\mathrm{Cd}$元素化合价升高失电子,故$\mathrm{Cd}$为负极,电极反应为$\mathrm{Cd}-2\mathrm{e^-}+2\mathrm{OH^-}=\mathrm{Cd(OH)_2}$,$\mathrm{NiOOH}$为正极,电极反应为$\mathrm{NiOOH}+\mathrm{H_2O}+\mathrm{e^-}=\mathrm{Ni(OH)_2}+\mathrm{OH^-}$,充电时,$\mathrm{Cd(OH)_2}$为阴极反应物,电极反应为$\mathrm{Cd(OH)_2}+2\mathrm{e^-}=\mathrm{Cd}+2\mathrm{OH^-}$,$\mathrm{Ni(OH)_2}$为阳极反应物,电极反应为$\mathrm{Ni(OH)_2}-\mathrm{e^-}+\mathrm{OH^-}=\mathrm{NiOOH}+\mathrm{H_2O}$。当飞船进入光照区时,太阳能电池可为镍镉电池充电,A正确;放电时Cd元素化合价升高失电子,Cd为负极,镍镉电池放电时负极反应:$\mathrm{Cd}-2\mathrm{e^-}+2\mathrm{OH^-}=\mathrm{Cd(OH)_2}$,B正确;充电时,$\mathrm{Ni(OH)_2}$为阳极反应物,镍镉电池充电时阳极反应:$\mathrm{Ni(OH)_2}-\mathrm{e^-}+\mathrm{OH^-}=\mathrm{NiOOH}+\mathrm{H_2O}$,C正确;镍镉电池充电时,电解质溶液中的$\mathrm{OH^-}$移向$\mathrm{NiOOH}$电极(阳极),D错误。
3. (2023·湖南株洲高二检测)自重轻、体积小、容量大、使用安全、环保是新型电池的典型特点,回答下列问题:
Ⅰ.“阿波罗”飞船中使用的氢氧燃料电池部分结构如图所示。

(1) 电池的正极为电极
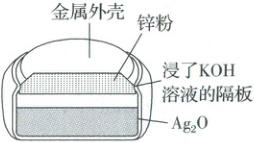
(2)“神舟”飞船是中国自行研制的,具有自主知识产权的载人飞船,其返回舱使用的是银锌蓄电池组。银锌电池结构如图所示,放电时总反应为$\mathrm{Ag_2O} + \mathrm{Zn} + \mathrm{H_2O} \longrightarrow 2\mathrm{Ag} + \mathrm{Zn(OH)_2}$。电池放电时负极质量
Ⅱ. 非水系锂氧($\mathrm{Li-O_2}$)电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图以及正极示意图分别为图 1 和图 2,隔膜 a 只允许$\mathrm{Li^+}$通过。


(3)放电时,电池的总反应为
(4)不考虑其他副反应,若放电前两电极质量完全相同,放电时,电路中转移 1 mol $\mathrm{e^-}$,正、负电极的质量之差为
Ⅰ.“阿波罗”飞船中使用的氢氧燃料电池部分结构如图所示。

(1) 电池的正极为电极
b
(填“a”或“b”),其表面上发生的电极反应为$\mathrm{O_2}+4\mathrm{e^-}+2\mathrm{H_2O}=4\mathrm{OH^-}$
。(2)“神舟”飞船是中国自行研制的,具有自主知识产权的载人飞船,其返回舱使用的是银锌蓄电池组。银锌电池结构如图所示,放电时总反应为$\mathrm{Ag_2O} + \mathrm{Zn} + \mathrm{H_2O} \longrightarrow 2\mathrm{Ag} + \mathrm{Zn(OH)_2}$。电池放电时负极质量
增大
(填“增大”“减小”或“不变”),电池放电时电解质溶液的 pH增大
。
Ⅱ. 非水系锂氧($\mathrm{Li-O_2}$)电池因其高能量密度而成为一种有前景的先进电池技术,其放电电池示意图以及正极示意图分别为图 1 和图 2,隔膜 a 只允许$\mathrm{Li^+}$通过。


(3)放电时,电池的总反应为
$2\mathrm{Li}+\mathrm{O_2}=\mathrm{Li_2O_2}$
;电解液 a 不选用$\mathrm{LiCl}$水溶液的原因可能是Li与水剧烈反应,产生易爆的$\mathrm{H_2}$,存在安全隐患(或其他合理答案)
。(4)不考虑其他副反应,若放电前两电极质量完全相同,放电时,电路中转移 1 mol $\mathrm{e^-}$,正、负电极的质量之差为
30
g(假设生成的不溶物全覆盖在电极表面,生成的可溶物全部扩散至电解液中,参与电极反应的物质均过量)(相对原子质量:$\mathrm{Li}$~7 $\mathrm{O}$~16)。
答案:
3.答案:
(1)b $\mathrm{O_2}+4\mathrm{e^-}+2\mathrm{H_2O}=4\mathrm{OH^-}$
(2)增大 增大
(3)$2\mathrm{Li}+\mathrm{O_2}=\mathrm{Li_2O_2}$ Li与水剧烈反应,产生易爆的$\mathrm{H_2}$,存在安全隐患(或其他合理答案)
(4)30
解析:
(1)氢氧燃料电池中,正极通入氧化剂,负极通入燃料,由图可知,电池的正极为电极b,其表面上发生的电极反应为$\mathrm{O_2}+4\mathrm{e^-}+2\mathrm{H_2O}=4\mathrm{OH^-}$。
(2)电池放电时的负极反应为$\mathrm{Zn}-2\mathrm{e^-}+2\mathrm{OH^-}=\mathrm{Zn(OH)_2}$,负极质量增大;根据总反应$\mathrm{Ag_2O}+\mathrm{Zn}+\mathrm{H_2O}=\mathrm{2Ag}+\mathrm{Zn(OH)_2}$,反应消耗了水,电解质浓度增大,溶液的pH增大。
(3)结合电池装置图,锂失电子作负极,电极反应为$\mathrm{Li}-\mathrm{e^-}=\mathrm{Li^+}$,正极电极反应为$\mathrm{O_2}+2\mathrm{e^-}+2\mathrm{Li^+}=\mathrm{Li_2O_2}$,放电时,电池的总反应为$2\mathrm{Li}+\mathrm{O_2}=\mathrm{Li_2O_2}$;电解液a不选用$\mathrm{LiCl}$水溶液的原因可能是Li与水剧烈反应,产生易爆的$\mathrm{H_2}$,存在安全隐患。
(4)结合第
(3)问可知,放电时,电路中转移$1\mathrm{mol}\ \mathrm{e^-}$,负极质量减少7g,正极的质量增加23g,正、负电极的质量之差为30g。
(1)b $\mathrm{O_2}+4\mathrm{e^-}+2\mathrm{H_2O}=4\mathrm{OH^-}$
(2)增大 增大
(3)$2\mathrm{Li}+\mathrm{O_2}=\mathrm{Li_2O_2}$ Li与水剧烈反应,产生易爆的$\mathrm{H_2}$,存在安全隐患(或其他合理答案)
(4)30
解析:
(1)氢氧燃料电池中,正极通入氧化剂,负极通入燃料,由图可知,电池的正极为电极b,其表面上发生的电极反应为$\mathrm{O_2}+4\mathrm{e^-}+2\mathrm{H_2O}=4\mathrm{OH^-}$。
(2)电池放电时的负极反应为$\mathrm{Zn}-2\mathrm{e^-}+2\mathrm{OH^-}=\mathrm{Zn(OH)_2}$,负极质量增大;根据总反应$\mathrm{Ag_2O}+\mathrm{Zn}+\mathrm{H_2O}=\mathrm{2Ag}+\mathrm{Zn(OH)_2}$,反应消耗了水,电解质浓度增大,溶液的pH增大。
(3)结合电池装置图,锂失电子作负极,电极反应为$\mathrm{Li}-\mathrm{e^-}=\mathrm{Li^+}$,正极电极反应为$\mathrm{O_2}+2\mathrm{e^-}+2\mathrm{Li^+}=\mathrm{Li_2O_2}$,放电时,电池的总反应为$2\mathrm{Li}+\mathrm{O_2}=\mathrm{Li_2O_2}$;电解液a不选用$\mathrm{LiCl}$水溶液的原因可能是Li与水剧烈反应,产生易爆的$\mathrm{H_2}$,存在安全隐患。
(4)结合第
(3)问可知,放电时,电路中转移$1\mathrm{mol}\ \mathrm{e^-}$,负极质量减少7g,正极的质量增加23g,正、负电极的质量之差为30g。
查看更多完整答案,请扫码查看


