2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第122页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
1. 碳酸钠的水解分两步:
${CO_{3}^{2-} + H_{2}O <=> HCO_{3}^{-} + OH^{-}}$$ $K_{h1}$;${HCO_{3}^{-} + H_{2}O <=> H_{2}CO_{3} + OH^{-}}$$ $K_{h2}$。
$K_{h1}$
${CO_{3}^{2-} + H_{2}O <=> HCO_{3}^{-} + OH^{-}}$$ $K_{h1}$;${HCO_{3}^{-} + H_{2}O <=> H_{2}CO_{3} + OH^{-}}$$ $K_{h2}$。
$K_{h1}$
>
(填“ > ”“ = ”或“ < ”)$K_{h2}$,原因是由水解常数与电离常数的表达式可知$K_{h1} = \frac{K_w}{K_{a2}}$,$K_{h2} = \frac{K_w}{K_{a1}}$,由于$K_{a1}>K_{a2}$,则$K_{h1}>K_{h2}$
。
答案:
1.$>$由水解常数与电离常数的表达式可知$K_ h1 = \frac{K_ w}{K_{ a2}}$,$K_ h2 = \frac{K_ w}{K_{ a1}}$
由于$K_{ a1}>K_{ a2}$,则$K_ h1>K_ h2$
由于$K_{ a1}>K_{ a2}$,则$K_ h1>K_ h2$
2. 利用以下数据分析,室温下,下列溶液的酸碱性及其原因。
H₂CO₃:$K_{a1} = 4.5×10^{-7}$ mol·L⁻¹,$K_{a2} = 4.7×10^{-11}$ mol·L⁻¹;H₂SO₃:$K_{a1} = 1.4×10^{-2}$ mol·L⁻¹,$K_{a2} = 6.0×10^{-8}$ mol·L⁻¹。
(1) NaHCO₃溶液显
(2) NaHSO₃溶液呈酸性的原因:
H₂CO₃:$K_{a1} = 4.5×10^{-7}$ mol·L⁻¹,$K_{a2} = 4.7×10^{-11}$ mol·L⁻¹;H₂SO₃:$K_{a1} = 1.4×10^{-2}$ mol·L⁻¹,$K_{a2} = 6.0×10^{-8}$ mol·L⁻¹。
(1) NaHCO₃溶液显
碱
(填“酸”“中”或“碱”)性,原因是(从水解程度和电离程度的相对大小进行分析,下同)HCO₃⁻的水解常数$K_h = \frac{K_w}{K_{a1}} = \frac{1 × 10^{-14}}{4.5 × 10^{-7}} mol · L^{-1} \approx 2.22 × 10^{-8} mol · L^{-1}$,则$K_h > K_{a2}$,因此HCO₃⁻的水解程度大于其电离程度,溶液呈碱性
。(2) NaHSO₃溶液呈酸性的原因:
HSO₃⁻的水解常数$K_h = \frac{K_w}{K_{a1}} = \frac{1 × 10^{-14}}{1.4 × 10^{-2}} mol · L^{-1} \approx 7.14 × 10^{-13} mol · L^{-1}$,则$K_h < K_{a2}$,因此HSO₃⁻的电离程度大于其水解程度,溶液呈酸性
。
答案:
2.
(1)碱 $ HCO_3^- + H_2 O \rightleftharpoons H_2 CO_3 + OH^-$,$ NaHCO_3$溶液中,水解程度和电离程度的相对大小可以用$ HCO_3^-$的水解常数($K_ h$)与电离常数($K_{ a2}$)的相对大小进行比较。
$K_ h = \frac{c_平( H_2 CO_3) · c_平( OH^-)}{c_平( HCO_3^-)} = \frac{c_平( H_2 CO_3) · c_平( OH^-) · c_平( H^+)}{c_平( HCO_3^-) · c_平( H^+)} = \frac{K_ w}{K_{ a1}} = \frac{1 × 10^{-14}}{4.5 × 10^{-7}} mol · L^{-1} \approx 2.22 × 10^{-8} mol · L^{-1}$,则$K_ h > K_{ a2}$,因此$ HCO_3^-$的水解程度大于其电离程度,溶液呈碱性
(2)$ HSO_3^- + H_2 O \rightleftharpoons H_2 SO_3 + OH^-$,
$K_ h = \frac{c_平( H_2 SO_3) · c_平( OH^-)}{c_平( HSO_3^-)} = \frac{c_平( H_2 SO_3) · c_平( OH^-) · c_平( H^+)}{c_平( HSO_3^-) · c_平( H^+)} = \frac{K_ w}{K_{ a1}} = \frac{1 × 10^{-14}}{1.4 × 10^{-2}} mol · L^{-1} \approx 7.14 × 10^{-13} mol · L^{-1}$,则$K_ h < K_{ a2}$,因此$ HSO_3^-$的电离程度大于其水解程度,溶液呈酸性。
(1)碱 $ HCO_3^- + H_2 O \rightleftharpoons H_2 CO_3 + OH^-$,$ NaHCO_3$溶液中,水解程度和电离程度的相对大小可以用$ HCO_3^-$的水解常数($K_ h$)与电离常数($K_{ a2}$)的相对大小进行比较。
$K_ h = \frac{c_平( H_2 CO_3) · c_平( OH^-)}{c_平( HCO_3^-)} = \frac{c_平( H_2 CO_3) · c_平( OH^-) · c_平( H^+)}{c_平( HCO_3^-) · c_平( H^+)} = \frac{K_ w}{K_{ a1}} = \frac{1 × 10^{-14}}{4.5 × 10^{-7}} mol · L^{-1} \approx 2.22 × 10^{-8} mol · L^{-1}$,则$K_ h > K_{ a2}$,因此$ HCO_3^-$的水解程度大于其电离程度,溶液呈碱性
(2)$ HSO_3^- + H_2 O \rightleftharpoons H_2 SO_3 + OH^-$,
$K_ h = \frac{c_平( H_2 SO_3) · c_平( OH^-)}{c_平( HSO_3^-)} = \frac{c_平( H_2 SO_3) · c_平( OH^-) · c_平( H^+)}{c_平( HSO_3^-) · c_平( H^+)} = \frac{K_ w}{K_{ a1}} = \frac{1 × 10^{-14}}{1.4 × 10^{-2}} mol · L^{-1} \approx 7.14 × 10^{-13} mol · L^{-1}$,则$K_ h < K_{ a2}$,因此$ HSO_3^-$的电离程度大于其水解程度,溶液呈酸性。
1. 影响盐类水解平衡的因素


答案:
1.大 促进 大 促进 抑制 促进
2. 外界条件对水解平衡影响的实例
${CH_{3}COONa}$溶液:${CH_{3}COO^{-} + H_{2}O \rightleftharpoons CH_{3}COOH + OH^{-}}$
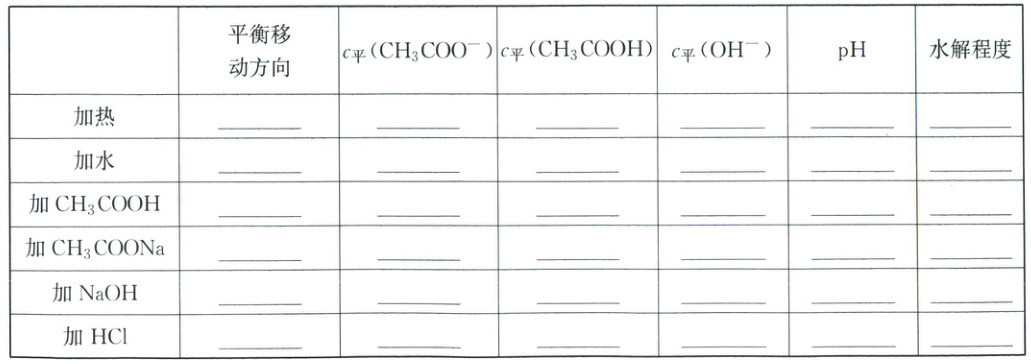
${CH_{3}COONa}$溶液:${CH_{3}COO^{-} + H_{2}O \rightleftharpoons CH_{3}COOH + OH^{-}}$

答案:
2.正向 减小 增大 增大 增大 增大 正向 减小 减小 减小 减小 增大 逆向 增大 增大 减小 减小 正向 增大 增大 正向 减小 增大 增大 减小 减小 增大
查看更多完整答案,请扫码查看


