2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第32页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
1. 铜的电解精炼
(1)铜的电解精炼原理
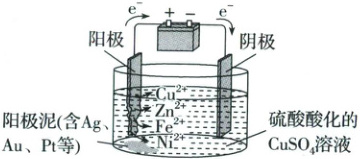
阳极材料:
阴极材料:
(2)电解精炼的结果
粗铜中比铜活泼的金属 $Zn$、$Fe$、$Ni$ 等失去电子形成的阳离子进入溶液;不如铜活泼的金属
(1)铜的电解精炼原理

阳极材料:
粗铜
,电极反应:$Cu - 2e^{-}=Cu^{2 + }$
;阴极材料:
精铜
,电极反应:$Cu^{2 + } + 2e^{-}=Cu$
;(2)电解精炼的结果
粗铜中比铜活泼的金属 $Zn$、$Fe$、$Ni$ 等失去电子形成的阳离子进入溶液;不如铜活泼的金属
$Ag$、$Au$、$Pt$
等以单质的形式沉积在电解池的底部,与其他不溶性杂质混在一起形成阳极泥;阴极上得到精铜
。
答案:
1.(1)粗铜 $Cu - 2e^{-}=Cu^{2 + }$ 精铜 $Cu^{2 + } + 2e^{-}=Cu$ (2)$Ag$、$Au$、$Pt$ 精铜
2. 电镀
(1)电镀:利用
(2)目的:使金属增强抗腐蚀能力、耐磨性或改善金属制品的外观。
(3)示例(在铁钉上面镀铜):
实验方案设计及实施
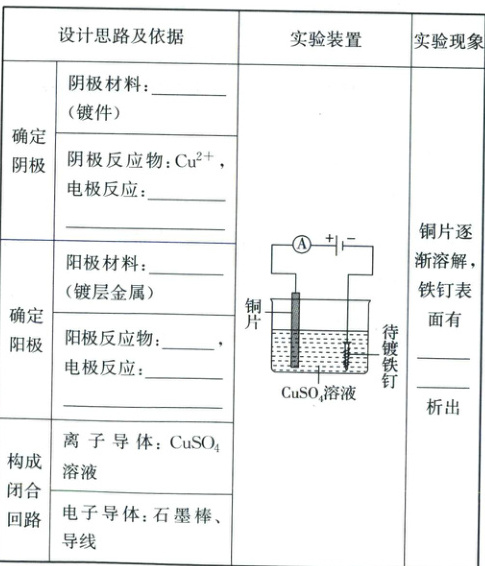
(4)电镀池的设计
一般都是用
(1)电镀:利用
电解
原理在某些金属表面镀上一薄层其他金属
或合金
的加工工艺。(2)目的:使金属增强抗腐蚀能力、耐磨性或改善金属制品的外观。
(3)示例(在铁钉上面镀铜):
实验方案设计及实施

(4)电镀池的设计
一般都是用
含有镀层金属离子的盐溶液
作电镀液;把镀层金属
浸入电镀液中与直流电源的正极相连,作阳极;镀件
与直流电源的负极相连,作阴极。
答案:
2.(1)电解 金属 合金 (2)铁钉 $Cu^{2 + } + 2e^{-}=Cu$ 铜片 铜片 $Cu - 2e^{-}=Cu^{2 + }$ 红色物质 (4)含有镀层金属离子的盐溶液 镀层金属 镀件
1. 在 $Fe$ 上电镀 $Zn$,应用 $Zn$ 作阳极,用 $ZnSO_4$ 溶液作电镀液。 (
2. 电解精炼铜时,粗铜作阳极,活泼性比 $Cu$ 弱的杂质金属成为阳极泥沉在阳极区。 (
3. 电镀铜和电解精炼铜时,电解质溶液中 $c(Cu^{2+})$ 均保持不变。 (
√
)2. 电解精炼铜时,粗铜作阳极,活泼性比 $Cu$ 弱的杂质金属成为阳极泥沉在阳极区。 (
√
)3. 电镀铜和电解精炼铜时,电解质溶液中 $c(Cu^{2+})$ 均保持不变。 (
×
)
答案:
1.√ 2.√ 3.×
火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电器工业的要求,工业上常使用电解精炼法将粗铜提纯。利用电解法可将含有 $Fe$、$Zn$、$Ag$、$Au$ 等杂质的粗铜提纯,回答下列问题:
(1)电解时粗铜作
(2)电解质溶液应选择
A. $CuCl_2$ 溶液
B. $CuSO_4$ 溶液
C. $ZnSO_4$ 溶液
(3)电解后,电解槽底部会形成含少量
(4)若纯铜片增重 $6.4\ g$,则电路通过的电子为
(1)电解时粗铜作
阳
极,连接电源的正
极,电极反应为$Cu - 2e^{-}=Cu^{2 + }$,$Fe - 2e^{-}=Fe^{2 + }$,$Zn - 2e^{-}=Zn^{2 + }$
;纯铜作阴
极,电极反应为$Cu^{2 + } + 2e^{-}=Cu$
。(2)电解质溶液应选择
B
(填字母)。A. $CuCl_2$ 溶液
B. $CuSO_4$ 溶液
C. $ZnSO_4$ 溶液
(3)电解后,电解槽底部会形成含少量
$Ag$、$Au$
等金属的阳极泥。(4)若纯铜片增重 $6.4\ g$,则电路通过的电子为
0.2
$mol$。
答案:
答案:(1)阳 正 $Cu - 2e^{-}=Cu^{2 + }$,$Fe - 2e^{-}=Fe^{2 + }$,$Zn -$ $2e^{-}=Zn^{2 + }$ 阴 $Cu^{2 + } + 2e^{-}=Cu$ (2)B (3)$Ag$、$Au$ (4)0.2
解析:(1)电解法精炼金属铜时,粗铜作阳极,失去电子逐渐溶解,溶液中的$Cu^{2 + }$得到电子后在阴极放电而析出,附着在阴极上,故粗铜作阳极,纯铜作阴极。(3)在电解时,比铜活泼的$Fe$、$Zn$先失去电子,变成$Fe^{2 + }$、$Zn^{2 + }$进入溶液,然后是铜失去电子,变成$Cu^{2 + }$进入溶液;$Ag$、$Au$等金属不如铜活泼,沉积在电解槽底部形成阳极泥。(4)$Cu^{2 + }$在阴极上得到电子形成$Cu$单质附着在阴极上,若纯铜片增重$6.4g$,$Cu$的物质的量是$0.1mol$,由于$Cu$是$ + 2$价金属,因此电路通过的电子为$0.2mol$。
解析:(1)电解法精炼金属铜时,粗铜作阳极,失去电子逐渐溶解,溶液中的$Cu^{2 + }$得到电子后在阴极放电而析出,附着在阴极上,故粗铜作阳极,纯铜作阴极。(3)在电解时,比铜活泼的$Fe$、$Zn$先失去电子,变成$Fe^{2 + }$、$Zn^{2 + }$进入溶液,然后是铜失去电子,变成$Cu^{2 + }$进入溶液;$Ag$、$Au$等金属不如铜活泼,沉积在电解槽底部形成阳极泥。(4)$Cu^{2 + }$在阴极上得到电子形成$Cu$单质附着在阴极上,若纯铜片增重$6.4g$,$Cu$的物质的量是$0.1mol$,由于$Cu$是$ + 2$价金属,因此电路通过的电子为$0.2mol$。
查看更多完整答案,请扫码查看


