2025年优化探究同步导学案高中化学选择性必修1人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年优化探究同步导学案高中化学选择性必修1人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第40页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
2. 城市地下潮湿的土壤中,常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法不正确的是()
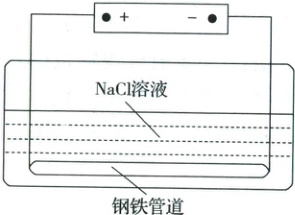
A.该装置能够将电能转化为化学能
B.管道右端腐蚀比左端快,右端电极反应为Fe - 2e⁻ = Fe²⁺
C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D.钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜

A.该装置能够将电能转化为化学能
B.管道右端腐蚀比左端快,右端电极反应为Fe - 2e⁻ = Fe²⁺
C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生吸氧腐蚀
D.钢铁“阳极保护”的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
答案:
2.BA.该装置相当于电解池,能将电能转化为化学能,正确;B.电解池中阳极被腐蚀,左端为阳极,其腐蚀速率较右端快,左端电极反应为$\mathrm{Fe-2e^{-}=Fe^{2+}}$,错误;C.如果没有外加电源,潮湿的土壤(接近中性)中的钢铁管道发生原电池反应,发生的是吸氧腐蚀,正确;D.根据题意,若电压等条件适宜,Fe在阳极失电子生成氧化物薄膜,能防止金属被腐蚀,所以“阳极保护”实际上是在阳极金属表面形成了一层致密的保护膜,正确。
3. 利用如图所示装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于M处还是N处?若X为锌,开关K置于M处还是N处?该防护法的名称是什么?


答案:
3.若X为碳棒,当开关K置于M处时,Fe为负极,被腐蚀;当开关K置于N处时,Fe为阴极,被保护,所以为减缓铁的腐蚀,开关K应置于N处。若X为锌,当开关K置于M处时,形成原电池,Zn为负极,Fe为正极,Fe被保护,该防护法属于牺牲阳极法。
1. 一次性保暖贴工作原理
铁与氧气的反应是一个放热反应,这个反应在自然条件下进行得很慢,但当它以电池反应的形式发生时则会变得很快,并放出大量的热。

铁与氧气的反应是一个放热反应,这个反应在自然条件下进行得很慢,但当它以电池反应的形式发生时则会变得很快,并放出大量的热。

答案:
1.铁粉 活性炭 $\mathrm{Fe-2e^{-}=Fe^{2+}}$ $\mathrm{O_{2}+2H_{2}O+4e^{-}=4OH^{-}}$
2. 微电解技术处理工业废水


[教材微拓展]
金属腐蚀快慢的比较
(1) 在同一电解质溶液中:电解池原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀 > 有防护措施的腐蚀。
(2) 同一种金属在相同浓度、不同介质中腐蚀,由快到慢的顺序为强电解质溶液 > 弱电解质溶液 > 非电解质溶液。
(3) 有无保护措施的腐蚀快慢顺序:无保护措施的金属腐蚀 > 有一定保护措施的金属腐蚀 > 牺牲阳极法引起的金属腐蚀 > 外加电流法引起的金属腐蚀。
(4) 对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀速率越快。
(5) 同一种金属A与另一较不活泼的金属B相连时,在相同的环境条件下,金属B越不活泼,金属A腐蚀越厉害。


[教材微拓展]
金属腐蚀快慢的比较
(1) 在同一电解质溶液中:电解池原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀 > 有防护措施的腐蚀。
(2) 同一种金属在相同浓度、不同介质中腐蚀,由快到慢的顺序为强电解质溶液 > 弱电解质溶液 > 非电解质溶液。
(3) 有无保护措施的腐蚀快慢顺序:无保护措施的金属腐蚀 > 有一定保护措施的金属腐蚀 > 牺牲阳极法引起的金属腐蚀 > 外加电流法引起的金属腐蚀。
(4) 对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀速率越快。
(5) 同一种金属A与另一较不活泼的金属B相连时,在相同的环境条件下,金属B越不活泼,金属A腐蚀越厉害。
答案:
2.铁屑中的铁 铁屑中的碳 $\mathrm{Fe-2e^{-}=Fe^{2+}}$ $\mathrm{O_{2}+2H_{2}O+4e^{-}}$
$\mathrm{=4OH^{-}}$ $\mathrm{2H^{+}+2e^{-}=H_{2}\uparrow}$
$\mathrm{=4OH^{-}}$ $\mathrm{2H^{+}+2e^{-}=H_{2}\uparrow}$
查看更多完整答案,请扫码查看


