2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第74页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
5.(2025·安徽·三模)下列过程对应的离子方程式正确的是 (
A.硫化钠溶液在空气中氧化变质:$\mathrm{2S^{2-}+O_2 +4H^+=2S\downarrow+2H_2O}$
B.过量$\mathrm{CO_2}$通入饱和碳酸钠溶液:$\mathrm{CO^{2-}_3 +CO_2 +H_2O=2HCO^-_3}$
C.少量$\mathrm{CO_2}$通入苯酚钠溶液:
D.$\mathrm{NaHCO_3}$溶液与少量$\mathrm{Ba(OH)_2}$溶液混合:$\mathrm{2HCO^-_3 +Ba^{2+}+2OH^-=BaCO_3\downarrow+CO^{2-}_3 +2H_2O}$
D
)A.硫化钠溶液在空气中氧化变质:$\mathrm{2S^{2-}+O_2 +4H^+=2S\downarrow+2H_2O}$
B.过量$\mathrm{CO_2}$通入饱和碳酸钠溶液:$\mathrm{CO^{2-}_3 +CO_2 +H_2O=2HCO^-_3}$
C.少量$\mathrm{CO_2}$通入苯酚钠溶液:

D.$\mathrm{NaHCO_3}$溶液与少量$\mathrm{Ba(OH)_2}$溶液混合:$\mathrm{2HCO^-_3 +Ba^{2+}+2OH^-=BaCO_3\downarrow+CO^{2-}_3 +2H_2O}$
答案:
[答案] D
[解析] A.硫化钠溶液呈碱性(S²⁻水解生成OH⁻),反应环境中无大量H⁺,离子方程式中不应出现H⁺,正确的氧化反应应在碱性条件下进行,应为2S²⁻+O₂+2H₂O═2S↓+4OH⁻,A错误;B.过量CO₂通入饱和碳酸钠溶液,生成的NaHCO₃溶解度小于Na₂CO₃,会析出晶体,离子方程式需标注NaHCO₃沉淀,离子方程式为2Na⁺+CO₃²⁻+CO₂+H₂O═2NaHCO₃↓,B错误;C.少量CO₂通入苯酚钠溶液,因苯酚酸性强于HCO₃⁻,产物应为苯酚和HCO₃⁻,而非CO₃²⁻,离子方程式为 +CO₂+H₂O→
+CO₂+H₂O→ OH+HCO₃⁻,C错误;D.少量Ba(OH)₂时,Ba²⁺与OH⁻按1:2完全反应,2molOH⁻需2molHCO₃⁻生成2molH₂O和2molCO₃²⁻,其中1molCO₃²⁻与Ba²⁺结合为BaCO₃↓,剩余1molCO₃²⁻,离子方程式正确,D正确;故选D。
OH+HCO₃⁻,C错误;D.少量Ba(OH)₂时,Ba²⁺与OH⁻按1:2完全反应,2molOH⁻需2molHCO₃⁻生成2molH₂O和2molCO₃²⁻,其中1molCO₃²⁻与Ba²⁺结合为BaCO₃↓,剩余1molCO₃²⁻,离子方程式正确,D正确;故选D。
[答案] D
[解析] A.硫化钠溶液呈碱性(S²⁻水解生成OH⁻),反应环境中无大量H⁺,离子方程式中不应出现H⁺,正确的氧化反应应在碱性条件下进行,应为2S²⁻+O₂+2H₂O═2S↓+4OH⁻,A错误;B.过量CO₂通入饱和碳酸钠溶液,生成的NaHCO₃溶解度小于Na₂CO₃,会析出晶体,离子方程式需标注NaHCO₃沉淀,离子方程式为2Na⁺+CO₃²⁻+CO₂+H₂O═2NaHCO₃↓,B错误;C.少量CO₂通入苯酚钠溶液,因苯酚酸性强于HCO₃⁻,产物应为苯酚和HCO₃⁻,而非CO₃²⁻,离子方程式为
 +CO₂+H₂O→
+CO₂+H₂O→ OH+HCO₃⁻,C错误;D.少量Ba(OH)₂时,Ba²⁺与OH⁻按1:2完全反应,2molOH⁻需2molHCO₃⁻生成2molH₂O和2molCO₃²⁻,其中1molCO₃²⁻与Ba²⁺结合为BaCO₃↓,剩余1molCO₃²⁻,离子方程式正确,D正确;故选D。
OH+HCO₃⁻,C错误;D.少量Ba(OH)₂时,Ba²⁺与OH⁻按1:2完全反应,2molOH⁻需2molHCO₃⁻生成2molH₂O和2molCO₃²⁻,其中1molCO₃²⁻与Ba²⁺结合为BaCO₃↓,剩余1molCO₃²⁻,离子方程式正确,D正确;故选D。 6.(2025·湖北武汉·二模)一种生产药物中间体三氟甲苯的方法为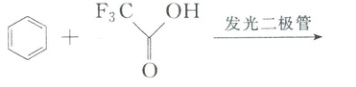
设$\mathrm{N_A}$为阿伏加德罗常数的值,已知25℃时三氟乙酸的$-\lg K_\mathrm{a}=0.23$,下列说法正确的是 (
A.$1\ \mathrm{mol}$三氟甲苯中$\sigma$键数目为$16\mathrm{N_A}$
B.25\ \celsius时,$1\ \mathrm{L\ 1\ mol·L^{-1}}$三氟乙酸溶液中,$\mathrm{OH^-}$的数目小于$10^{-14}\mathrm{N_A}$
C.标准状况下,$\mathrm{H_2}$和$\mathrm{CO_2}$按任意体积比组成的$1.12\ \mathrm{L}$混合气体中,氢、氧原子总数为$0.1\mathrm{N_A}$
D.$7.8\ \mathrm{g}$苯中碳碳双键数目为$0.3\mathrm{N_A}$

设$\mathrm{N_A}$为阿伏加德罗常数的值,已知25℃时三氟乙酸的$-\lg K_\mathrm{a}=0.23$,下列说法正确的是 (
C
)A.$1\ \mathrm{mol}$三氟甲苯中$\sigma$键数目为$16\mathrm{N_A}$
B.25\ \celsius时,$1\ \mathrm{L\ 1\ mol·L^{-1}}$三氟乙酸溶液中,$\mathrm{OH^-}$的数目小于$10^{-14}\mathrm{N_A}$
C.标准状况下,$\mathrm{H_2}$和$\mathrm{CO_2}$按任意体积比组成的$1.12\ \mathrm{L}$混合气体中,氢、氧原子总数为$0.1\mathrm{N_A}$
D.$7.8\ \mathrm{g}$苯中碳碳双键数目为$0.3\mathrm{N_A}$
答案:
[答案] C
[解析] A.三氟甲苯结构的苯环含6个C—Cσ键、5个C—Hσ键,苯环与—CF₃间有1个C—Cσ键,—CF₃含3个C—Fσ键,共6+5+1+3=15个σ键,1mol中σ键数目为15Nₐ,A错误;B.25℃时Kₙ=10⁻¹⁴,三氟乙酸为弱酸(Kₐ=10⁻⁰.²³≈0.59),1mol/L溶液中c(H⁺)<1mol/L,故c(OH⁻)=Kₙ/c(H⁺)>10⁻¹⁴mol/L,OH⁻数目大于10⁻¹⁴Nₐ,B错误;C.标准状况下1.12L混合气体为0.05mol(H₂和CO₂),设H₂为xmol、CO₂为ymol,x+y=0.05。氢原子数=2x,氧原子数=2y,总原子数=2(x+y)=0.1mol,即0.1Nₐ,C正确;D.苯分子中无碳碳双键,碳碳键为介于单双键间的特殊键,D错误;故选C。
[解析] A.三氟甲苯结构的苯环含6个C—Cσ键、5个C—Hσ键,苯环与—CF₃间有1个C—Cσ键,—CF₃含3个C—Fσ键,共6+5+1+3=15个σ键,1mol中σ键数目为15Nₐ,A错误;B.25℃时Kₙ=10⁻¹⁴,三氟乙酸为弱酸(Kₐ=10⁻⁰.²³≈0.59),1mol/L溶液中c(H⁺)<1mol/L,故c(OH⁻)=Kₙ/c(H⁺)>10⁻¹⁴mol/L,OH⁻数目大于10⁻¹⁴Nₐ,B错误;C.标准状况下1.12L混合气体为0.05mol(H₂和CO₂),设H₂为xmol、CO₂为ymol,x+y=0.05。氢原子数=2x,氧原子数=2y,总原子数=2(x+y)=0.1mol,即0.1Nₐ,C正确;D.苯分子中无碳碳双键,碳碳键为介于单双键间的特殊键,D错误;故选C。
7.(2025·湖南长沙·二模)一种矿石的化学组成为$\mathrm{X_3Z_2W_6Y_{18}}$。X、Y、Z、W为原子序数依次增加的短周期元素,且价层电子数之和为$15$,X、Z、W处于相邻的主族,$\mathrm{X^{2+}}$和$\mathrm{Z^{3+}}$的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是 (
A.与Z同周期的元素中,第一电离能比Z大的元素有6种
B.四种元素形成的单质中,沸点最高的是Z
C.W、Y的简单氢化物中,键角:W<Z
D.X的单质可以和盐酸反应,不能与氢氧化钠溶液反应
A
)A.与Z同周期的元素中,第一电离能比Z大的元素有6种
B.四种元素形成的单质中,沸点最高的是Z
C.W、Y的简单氢化物中,键角:W<Z
D.X的单质可以和盐酸反应,不能与氢氧化钠溶液反应
答案:
[答案] A
[分析] X、Y、Z、W为原子序数依次增加的短周期元素,X、Z、W处于相邻的主族,X²⁺和Z³⁺的电荷与半径之比相近,导致两元素性质相似,二种元素遵循对角线规则,可知X为Be元素、Z为Al元素,故W为ⅣA族的Si元素;同时四种元素价层电子数之和为15,则Y的价层电子数为:15 - 2 - 3 - 4 = 6,结合原子序数相对大小推知Y为O元素,然后根据问题分析解答。
[解析] 根据上述分析可知:X是Be,Y是O,Z是Al,W是Si元素。A.一般情况下,同一周期元素,原子序数越大,元素的第一电离能就越大。但当元素处于第ⅡA、第ⅤA时,由于原子核外电子处于轨道的全满、半满的稳定状态,其第一电离能大于同一周期相邻元素。Z是Al元素,与Al同周期的第三周期元素中,第一电离能比Al大的有Mg、Si、S、P、Cl、Ar,共6种,A正确;B.在上述四种元素形成的单质中,Si为共价晶体,其沸点最高,而不是金属晶体的Al,B错误;C.根据上述分析可知:Y是O,W是Si元素。它们形成的简单氢化物分别是H₂O、SiH₄。其中SiH₄中Si原子采用sp³杂化,价层电子对数是4+(4 - 4×1)/2 = 4,无孤电子对,SiH₄呈正四面体结构,键角为109.28°;H₂O中的中心O原子也采用sp³杂化,价层电子对数是:2+(6 - 2×1)/2 = 4,有2对孤电子对,由于孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,导致H₂O分子中的键角为104.5°,故键角:SiH₄>H₂O,C错误;D.Be与Al类似,既能与盐酸反应,又能与NaOH溶液反应,D错误;故合理选项是A。
[分析] X、Y、Z、W为原子序数依次增加的短周期元素,X、Z、W处于相邻的主族,X²⁺和Z³⁺的电荷与半径之比相近,导致两元素性质相似,二种元素遵循对角线规则,可知X为Be元素、Z为Al元素,故W为ⅣA族的Si元素;同时四种元素价层电子数之和为15,则Y的价层电子数为:15 - 2 - 3 - 4 = 6,结合原子序数相对大小推知Y为O元素,然后根据问题分析解答。
[解析] 根据上述分析可知:X是Be,Y是O,Z是Al,W是Si元素。A.一般情况下,同一周期元素,原子序数越大,元素的第一电离能就越大。但当元素处于第ⅡA、第ⅤA时,由于原子核外电子处于轨道的全满、半满的稳定状态,其第一电离能大于同一周期相邻元素。Z是Al元素,与Al同周期的第三周期元素中,第一电离能比Al大的有Mg、Si、S、P、Cl、Ar,共6种,A正确;B.在上述四种元素形成的单质中,Si为共价晶体,其沸点最高,而不是金属晶体的Al,B错误;C.根据上述分析可知:Y是O,W是Si元素。它们形成的简单氢化物分别是H₂O、SiH₄。其中SiH₄中Si原子采用sp³杂化,价层电子对数是4+(4 - 4×1)/2 = 4,无孤电子对,SiH₄呈正四面体结构,键角为109.28°;H₂O中的中心O原子也采用sp³杂化,价层电子对数是:2+(6 - 2×1)/2 = 4,有2对孤电子对,由于孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,导致H₂O分子中的键角为104.5°,故键角:SiH₄>H₂O,C错误;D.Be与Al类似,既能与盐酸反应,又能与NaOH溶液反应,D错误;故合理选项是A。
8.(2025·山东潍坊·二模)乙酰水杨酸( ),是白色晶体,易溶于有机溶剂,微溶于水,在水中溶解度随温度升高而增大;受热易分解。通过水杨酸(
),是白色晶体,易溶于有机溶剂,微溶于水,在水中溶解度随温度升高而增大;受热易分解。通过水杨酸( )、乙酸酐$[(\mathrm{CH_3CO})_2\mathrm{O}]$合成及提纯过程如下:
)、乙酸酐$[(\mathrm{CH_3CO})_2\mathrm{O}]$合成及提纯过程如下:
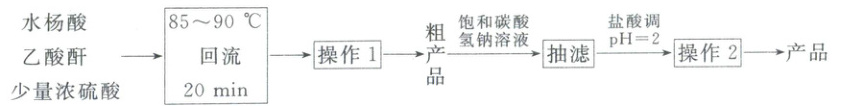
下列说法正确的是 (
A.浓硫酸的作用为催化剂、吸水剂
B.操作1和操作2均包含冷却结晶、过滤
C.饱和碳酸氢钠溶液可以用氢氧化钠溶液代替
D.盐酸的主要作用是除去碳酸氢钠
 ),是白色晶体,易溶于有机溶剂,微溶于水,在水中溶解度随温度升高而增大;受热易分解。通过水杨酸(
),是白色晶体,易溶于有机溶剂,微溶于水,在水中溶解度随温度升高而增大;受热易分解。通过水杨酸( )、乙酸酐$[(\mathrm{CH_3CO})_2\mathrm{O}]$合成及提纯过程如下:
)、乙酸酐$[(\mathrm{CH_3CO})_2\mathrm{O}]$合成及提纯过程如下:
下列说法正确的是 (
B
)A.浓硫酸的作用为催化剂、吸水剂
B.操作1和操作2均包含冷却结晶、过滤
C.饱和碳酸氢钠溶液可以用氢氧化钠溶液代替
D.盐酸的主要作用是除去碳酸氢钠
答案:
[答案] B
[分析] (水杨酸)和(CH₃CO)₂O(醋酸酐)发生取代反应生成乙酰水杨酸,方程式为
(水杨酸)和(CH₃CO)₂O(醋酸酐)发生取代反应生成乙酰水杨酸,方程式为 
[解析] A.根据分析可知,方程式中无水生成,只做催化剂,A错误;B.根据分析可知,操作1和操作2均包含冷却结晶、过滤,B正确;C.饱和碳酸氢钠溶液的作用是生成可溶的乙酰水杨酸钠( ),不可以用氢氧化钠溶液代替,会使
),不可以用氢氧化钠溶液代替,会使  水解,C错误;D.根据分析可知,盐酸的主要作用是生成乙酰水杨酸,D错误;故选B。
水解,C错误;D.根据分析可知,盐酸的主要作用是生成乙酰水杨酸,D错误;故选B。
[答案] B
[分析]
 (水杨酸)和(CH₃CO)₂O(醋酸酐)发生取代反应生成乙酰水杨酸,方程式为
(水杨酸)和(CH₃CO)₂O(醋酸酐)发生取代反应生成乙酰水杨酸,方程式为 
[解析] A.根据分析可知,方程式中无水生成,只做催化剂,A错误;B.根据分析可知,操作1和操作2均包含冷却结晶、过滤,B正确;C.饱和碳酸氢钠溶液的作用是生成可溶的乙酰水杨酸钠(
 ),不可以用氢氧化钠溶液代替,会使
),不可以用氢氧化钠溶液代替,会使  水解,C错误;D.根据分析可知,盐酸的主要作用是生成乙酰水杨酸,D错误;故选B。
水解,C错误;D.根据分析可知,盐酸的主要作用是生成乙酰水杨酸,D错误;故选B。 查看更多完整答案,请扫码查看


