2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
12.(2025·湖北·模拟预测)室温下实验探究$Co^{2+}$、$Co^{3+}$能否催化$H_2O_2$的分解及相关性质。下列说法不正确的是(
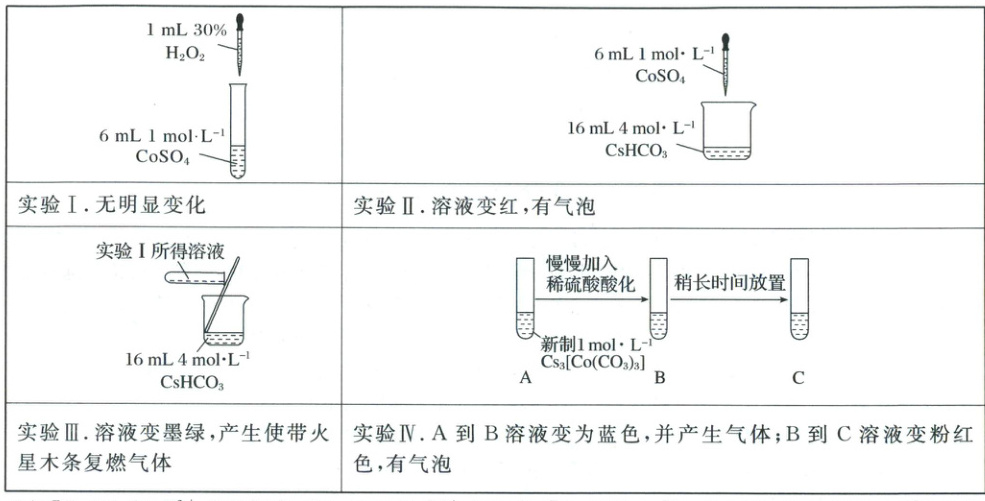
已知$[Co(H_2O)_6]^{2+}$为粉红色、$[Co(H_2O)_6]^{3+}$为蓝色、$[Co(CO_3)_2]^{2-}$为红色、$[Co(CO_3)_3]^{3-}$为墨绿色。
A.$CO_3^{2-}$加入利于反应$2[Co(H_2O)_6]^{2+}+H_2O_2+2H^+=2[Co(H_2O)_6]^{3+}+2H_2O$正向移动
B.实验Ⅱ中反应离子方程式:$4HCO_3^-+Co^{2+}=[Co(CO_3)_2]^{2-}+2CO_2\uparrow+2H_2O$
C.实验Ⅲ中产生的气体只有$O_2$
D.实验Ⅳ中,从A到C所产生的气体分别为$CO_2$、$O_2$
C
)
已知$[Co(H_2O)_6]^{2+}$为粉红色、$[Co(H_2O)_6]^{3+}$为蓝色、$[Co(CO_3)_2]^{2-}$为红色、$[Co(CO_3)_3]^{3-}$为墨绿色。
A.$CO_3^{2-}$加入利于反应$2[Co(H_2O)_6]^{2+}+H_2O_2+2H^+=2[Co(H_2O)_6]^{3+}+2H_2O$正向移动
B.实验Ⅱ中反应离子方程式:$4HCO_3^-+Co^{2+}=[Co(CO_3)_2]^{2-}+2CO_2\uparrow+2H_2O$
C.实验Ⅲ中产生的气体只有$O_2$
D.实验Ⅳ中,从A到C所产生的气体分别为$CO_2$、$O_2$
答案:
12.[答案] C
[解析] A.实验 Ⅰ 表明,$2[Co(H_2O)_6]^{2+} + H_2O + 2H^+ \longrightarrow 2[Co(H_2O)_6]^{3+} + 2H_2O$ 反应难以正向进行。实验 Ⅲ 的现象表明,$Co^{3+}$、$Co^{2+}$ 分别与 $CO_3^{2-}$ 配位时,$[Co(H_2O)_6]^{3+}$ 更易与 $CO_3^{2-}$ 反应生成 $[Co(CO_3)_3]^{3-}$(该反应为快反应),导致 $[Co(H_2O)_6]^{2+}$ 几乎不能转化为 $[Co(CO_3)_3]^{2-}$,这样使得 $[Co(H_2O)_6]^{2+}$ 的浓度减小的幅度远远大于 $[Co(H_2O)_6]^{3+}$ 减小的幅度,根据化学平衡移动原理,减小生成物浓度能使化学平衡向正反应方向移动,因此,$CO_3^{2-}$ 加入有利于反应 $2[Co(H_2O)_6]^{2+} + H_2O + 2H^+ \longrightarrow 2[Co(H_2O)_6]^{3+} + 2H_2O$ 正向移动,A 正确;B.实验 Ⅱ 中溶液变为红色,证明生成 $[Co(CO_3)_3]^{2-}$,实验 Ⅱ 中反应离子方程式:$4HCO_3^- + Co^{2+} \longrightarrow [Co(CO_3)_3]^{2-} + 2CO_2 \uparrow + 2H_2O$,故 B 正确;实验 Ⅲ 中溶液变为墨绿色,说明 $[Co(H_2O)_6]^{2+}$ 更易转化为 $[Co(CO_3)_3]^{3-}$,反应为 $2[Co(H_2O)_6]^{2+} + 10HCO_3^- + H_2O \longrightarrow 2[Co(CO_3)_3]^{3-} + 18H_2O + 4CO_2 \uparrow$,也会生成二氧化碳,故 C 错误;D.由分析 Ⅳ 中,从 A 到 C 所产生的气体分别为 $CO_2$、$O_2$,D 正确;故选 C。
[解析] A.实验 Ⅰ 表明,$2[Co(H_2O)_6]^{2+} + H_2O + 2H^+ \longrightarrow 2[Co(H_2O)_6]^{3+} + 2H_2O$ 反应难以正向进行。实验 Ⅲ 的现象表明,$Co^{3+}$、$Co^{2+}$ 分别与 $CO_3^{2-}$ 配位时,$[Co(H_2O)_6]^{3+}$ 更易与 $CO_3^{2-}$ 反应生成 $[Co(CO_3)_3]^{3-}$(该反应为快反应),导致 $[Co(H_2O)_6]^{2+}$ 几乎不能转化为 $[Co(CO_3)_3]^{2-}$,这样使得 $[Co(H_2O)_6]^{2+}$ 的浓度减小的幅度远远大于 $[Co(H_2O)_6]^{3+}$ 减小的幅度,根据化学平衡移动原理,减小生成物浓度能使化学平衡向正反应方向移动,因此,$CO_3^{2-}$ 加入有利于反应 $2[Co(H_2O)_6]^{2+} + H_2O + 2H^+ \longrightarrow 2[Co(H_2O)_6]^{3+} + 2H_2O$ 正向移动,A 正确;B.实验 Ⅱ 中溶液变为红色,证明生成 $[Co(CO_3)_3]^{2-}$,实验 Ⅱ 中反应离子方程式:$4HCO_3^- + Co^{2+} \longrightarrow [Co(CO_3)_3]^{2-} + 2CO_2 \uparrow + 2H_2O$,故 B 正确;实验 Ⅲ 中溶液变为墨绿色,说明 $[Co(H_2O)_6]^{2+}$ 更易转化为 $[Co(CO_3)_3]^{3-}$,反应为 $2[Co(H_2O)_6]^{2+} + 10HCO_3^- + H_2O \longrightarrow 2[Co(CO_3)_3]^{3-} + 18H_2O + 4CO_2 \uparrow$,也会生成二氧化碳,故 C 错误;D.由分析 Ⅳ 中,从 A 到 C 所产生的气体分别为 $CO_2$、$O_2$,D 正确;故选 C。
13.(2025·黑龙江哈尔滨·三模)某温度下向容器中加入M发生如下反应:①$M\to P$,②$M\to Q$,③$P\rightleftharpoons Q$。反应体系中M、P、Q的浓度随时间t的变化曲线如图所示。下列说法正确的是(

A.$t_1$时,反应③已达平衡
B.$t_2$时,$c(Q)=c_0-c(P)$
C.反应①的活化能大于反应②
D.该温度下,反应③的平衡常数小于1
B
)
A.$t_1$时,反应③已达平衡
B.$t_2$时,$c(Q)=c_0-c(P)$
C.反应①的活化能大于反应②
D.该温度下,反应③的平衡常数小于1
答案:
13.[答案] B
[解析] A.$t_1$ 时后,P 继续减少、Q 增多,反应 ③ 没有达到平衡状态,故 A 错误;B.根据图示,$t_2$ 时 M 的浓度为 0,M 完全转化为 P、Q,则 $c(Q) = c_0 - c(P)$,故 B 正确;C.$t_1$ 时刻前,P 的浓度大于 Q,说明反应 ① 的转化浓度大于反应 ②,反应 ① 的速率大于反应 ②,则反应 ① 的活化能小于反应 ②,故 C 错误;D.该温度下,反应达到平衡,Q 浓度大于 P,反应 ③ 的平衡常数大于 $\frac{c(Q)}{c(P)} > 1$,故 D 错误;故选 B。
[解析] A.$t_1$ 时后,P 继续减少、Q 增多,反应 ③ 没有达到平衡状态,故 A 错误;B.根据图示,$t_2$ 时 M 的浓度为 0,M 完全转化为 P、Q,则 $c(Q) = c_0 - c(P)$,故 B 正确;C.$t_1$ 时刻前,P 的浓度大于 Q,说明反应 ① 的转化浓度大于反应 ②,反应 ① 的速率大于反应 ②,则反应 ① 的活化能小于反应 ②,故 C 错误;D.该温度下,反应达到平衡,Q 浓度大于 P,反应 ③ 的平衡常数大于 $\frac{c(Q)}{c(P)} > 1$,故 D 错误;故选 B。
14.(2025·黑龙江齐齐哈尔·二模)利用平衡移动原理,分析常温下$Ni^{2+}$在不同pH的$K_2CO_3$体系中的可能产物。已知:图1中曲线表示$K_2CO_3$体系中各含碳粒子的物质的量分数与pH的关系;图2中曲线Ⅰ的离子浓度关系符合$c(Ni^{2+})· c(CO_3^{2-})=K_{sp}(NiCO_3)$;曲线Ⅱ的离子浓度关系符合$c(Ni^{2+})· c^2(OH^-)=K_{sp}[Ni(OH)_2]$;[注:起始$K_2CO_3$体系中$c(CO_3^{2-})+c(HCO_3^-)+c(H_2CO_3)=0.1mol· L^{-1}$;不同pH下$c(CO_3^{2-})$由图1得到]。下列说法正确的是(

A.M点时,溶液中存在$c(OH^-)>c(CO_3^{2-})$
B.pH=8时,碳酸钾溶液体系中存在:$c(CO_3^{2-})>c(H_2CO_3)$
C.初始状态pH=9、$lg[c(Ni^{2+})]=-5$,平衡后存在$c(CO_3^{2-})+c(HCO_3^-)+c(H_2CO_3)=0.1mol· L^{-1}$
D.沉淀$Ni^{2+}$制备$NiCO_3$时,选用$0.1mol· L^{-1}K_2CO_3$溶液比$0.1mol· L^{-1}KHCO_3$溶液效果好
C
)
A.M点时,溶液中存在$c(OH^-)>c(CO_3^{2-})$
B.pH=8时,碳酸钾溶液体系中存在:$c(CO_3^{2-})>c(H_2CO_3)$
C.初始状态pH=9、$lg[c(Ni^{2+})]=-5$,平衡后存在$c(CO_3^{2-})+c(HCO_3^-)+c(H_2CO_3)=0.1mol· L^{-1}$
D.沉淀$Ni^{2+}$制备$NiCO_3$时,选用$0.1mol· L^{-1}K_2CO_3$溶液比$0.1mol· L^{-1}KHCO_3$溶液效果好
答案:
14.[答案] C
[分析] $pH = 6.37$ 时,$c(H_2CO_3) = c(HCO_3^-)$,故有 $K_{a1}(H_2CO_3) = \frac{c(HCO_3^-)}{c(H_2CO_3)} × c(H^+) = c(H^+) = 10^{-6.37}$;$pH = 10.25$ 时 $c(CO_3^{2-}) = c(HCO_3^-)$,此时 $K_{a2}(H_2CO_3) = \frac{c(CO_3^{2-})}{c(HCO_3^-)} × c(H^+) = c(H^+) = 10^{-10.25}$。
[解析] A.$K_{a2}(H_2CO_3) = \frac{c(CO_3^{2-})}{c(HCO_3^-)} × c(H^+) = 10^{-10.25}$,M 点时 $pH = 8.25$,$c(H^+) = 10^{-8.25} mol/L$,$c(OH^-) = \frac{10^{-14}}{10^{-8.25}} mol/L = 10^{-5.75} mol/L$,溶液中 $c(HCO_3^-) \approx 0.1 mol/L$,则 $c(CO_3^{2-}) = \frac{K_{a2}(H_2CO_3) c(HCO_3^-)}{c(H^+)} = 10^{-10.25} × \frac{0.1 × \frac{1}{10^{-8.25}} mol/L}{ } = 10^{-3} mol/L$,所以 M 点时,溶液中存在:$c(CO_3^{2-}) > c(OH^-)$,故 A 错误;B.$K_{a1} · K_{a2} = \frac{c(CO_3^{2-})}{c(H_2CO_3)} × c^2(H^+) = 10^{-6.37} × 10^{-10.25}$,$pH = 8$ 时,$c(H^+) = 10^{-8} mol · L^{-1}$,则 $\frac{c(CO_3^{2-})}{c(H_2CO_3)} = 10^{-0.62} < 1$,即碳酸钾溶液体系中存在:$c(CO_3^{2-}) < c(H_2CO_3)$,故 B 错误;C.由图可知,初始状态为 $pH = 9$、$\lg[c(Ni^{2+})] = -5$,此时为 $Ni(OH)_2$ 的沉淀溶解平衡体系,不会生成 $NiCO_3$,含碳微粒总量不变,即体系达平衡后存在:$c(CO_3^{2-}) + c(HCO_3^-) + c(H_2CO_3) = 0.1 mol/L$,故 C 正确;D.由图 2 可知 $pH < 8.25$ 时,$NiCO_3$ 优先于 $Ni(OH)_2$ 生成沉淀,$pH > 8.25$ 时 $Ni(OH)_2$ 优先于 $NiCO_3$ 生成沉淀,$0.1 mol · L^{-1} KHCO_3$ 溶液的 $pH$ 接近 8,$0.1 mol · L^{-1} K_2CO_3$ 溶液的 $pH$ 接近 12,所以沉淀 $Ni^{2+}$ 制备 $NiCO_3$ 时,选用 $0.1 mol · L^{-1} KHCO_3$ 溶液比 $0.1 mol · L^{-1} K_2CO_3$ 溶液的效果好,故 D 错误;故选 C。
[分析] $pH = 6.37$ 时,$c(H_2CO_3) = c(HCO_3^-)$,故有 $K_{a1}(H_2CO_3) = \frac{c(HCO_3^-)}{c(H_2CO_3)} × c(H^+) = c(H^+) = 10^{-6.37}$;$pH = 10.25$ 时 $c(CO_3^{2-}) = c(HCO_3^-)$,此时 $K_{a2}(H_2CO_3) = \frac{c(CO_3^{2-})}{c(HCO_3^-)} × c(H^+) = c(H^+) = 10^{-10.25}$。
[解析] A.$K_{a2}(H_2CO_3) = \frac{c(CO_3^{2-})}{c(HCO_3^-)} × c(H^+) = 10^{-10.25}$,M 点时 $pH = 8.25$,$c(H^+) = 10^{-8.25} mol/L$,$c(OH^-) = \frac{10^{-14}}{10^{-8.25}} mol/L = 10^{-5.75} mol/L$,溶液中 $c(HCO_3^-) \approx 0.1 mol/L$,则 $c(CO_3^{2-}) = \frac{K_{a2}(H_2CO_3) c(HCO_3^-)}{c(H^+)} = 10^{-10.25} × \frac{0.1 × \frac{1}{10^{-8.25}} mol/L}{ } = 10^{-3} mol/L$,所以 M 点时,溶液中存在:$c(CO_3^{2-}) > c(OH^-)$,故 A 错误;B.$K_{a1} · K_{a2} = \frac{c(CO_3^{2-})}{c(H_2CO_3)} × c^2(H^+) = 10^{-6.37} × 10^{-10.25}$,$pH = 8$ 时,$c(H^+) = 10^{-8} mol · L^{-1}$,则 $\frac{c(CO_3^{2-})}{c(H_2CO_3)} = 10^{-0.62} < 1$,即碳酸钾溶液体系中存在:$c(CO_3^{2-}) < c(H_2CO_3)$,故 B 错误;C.由图可知,初始状态为 $pH = 9$、$\lg[c(Ni^{2+})] = -5$,此时为 $Ni(OH)_2$ 的沉淀溶解平衡体系,不会生成 $NiCO_3$,含碳微粒总量不变,即体系达平衡后存在:$c(CO_3^{2-}) + c(HCO_3^-) + c(H_2CO_3) = 0.1 mol/L$,故 C 正确;D.由图 2 可知 $pH < 8.25$ 时,$NiCO_3$ 优先于 $Ni(OH)_2$ 生成沉淀,$pH > 8.25$ 时 $Ni(OH)_2$ 优先于 $NiCO_3$ 生成沉淀,$0.1 mol · L^{-1} KHCO_3$ 溶液的 $pH$ 接近 8,$0.1 mol · L^{-1} K_2CO_3$ 溶液的 $pH$ 接近 12,所以沉淀 $Ni^{2+}$ 制备 $NiCO_3$ 时,选用 $0.1 mol · L^{-1} KHCO_3$ 溶液比 $0.1 mol · L^{-1} K_2CO_3$ 溶液的效果好,故 D 错误;故选 C。
查看更多完整答案,请扫码查看


