2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第55页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
17. (15分)(2025·山东·二模)钼钢具有高强度、高韧性、耐腐蚀等优良性能。一种利用钼渣[含CaMoO₄、Fe₂(MoO₄)₃、PbMoO₄、MoS₂]制备钼酸铵的流程如图所示:
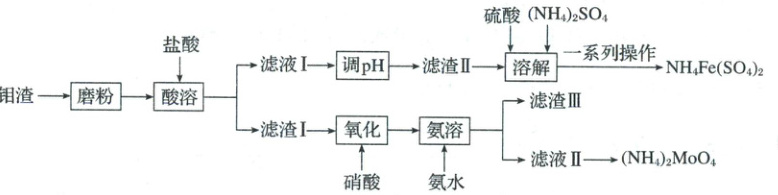
已知:①钼酸(H₂MoO₄)不溶于水;②当溶液中某离子浓度c(Mⁿ⁺) ≤ 1×10⁻⁵ mol·L⁻¹时,可认为该离子沉淀完全;常温下,几种沉淀的Ksp如下表所示:

回答下列问题:
(1)“磨粉”操作的目的是
(2)“调pH”可加入CaCO₃,生成“滤渣Ⅱ”的离子方程式为
(3)稀硝酸氧化时将MoS₂转化为H₂MoO₄和H₂SO₄,该反应的离子方程式为________________________,“滤渣Ⅲ”的主要成分为________。
(4)钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO₄ - Fe₂O₃保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是
A. 适量的N₂
B. NaNO₂
C. 油脂
D. 盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图所示。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是

已知:①钼酸(H₂MoO₄)不溶于水;②当溶液中某离子浓度c(Mⁿ⁺) ≤ 1×10⁻⁵ mol·L⁻¹时,可认为该离子沉淀完全;常温下,几种沉淀的Ksp如下表所示:

回答下列问题:
(1)“磨粉”操作的目的是
增大接触面积,加快反应速率,提高浸取率
,实验室模拟该操作所需主要仪器是研钵
。(2)“调pH”可加入CaCO₃,生成“滤渣Ⅱ”的离子方程式为
2Fe³⁺ + 3CaCO₃ + 3H₂O = 2Fe(OH)₃↓ + 3Ca²⁺ + 3CO₂↑
,向“滤渣Ⅱ”加入硫酸和(NH₄)₂SO₄溶解,再经一系列操作可得NH₄Fe(SO₄)₂,则理论上加入n(H₂SO₄) : n[(NH₄)₂SO₄] = 1:1
。(3)稀硝酸氧化时将MoS₂转化为H₂MoO₄和H₂SO₄,该反应的离子方程式为________________________,“滤渣Ⅲ”的主要成分为________。
(4)钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO₄ - Fe₂O₃保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是
B
(填字母)。A. 适量的N₂
B. NaNO₂
C. 油脂
D. 盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图所示。

当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是
浓硫酸具有强氧化性,在碳钢表面形成一层致密的氧化膜,阻止了进一步腐蚀
。若缓蚀剂为钼酸钠 - 月桂酰肌氨酸(总浓度为300 mg·L⁻¹),缓蚀效果最好时,钼酸钠(M = 206 g·mol⁻¹)的物质的量浓度为7.3×10⁻⁴
mol·L⁻¹(保留2位有效数字)。
答案:
17.[答案]
(1)增大接触面积,加快反应速率,提高浸取率;研钵
(2)2Fe³⁺ + 3CaCO₃ + 3H₂O = 2Fe(OH)₃↓ + 3Ca²⁺ + 3CO₂↑;1:1
(3)MoS₂ + 9NO₃⁻ + 6H⁺ = MoO₄²⁻ + 2SO₄²⁻ + 9NO↑ + 3H₂O;PbSO₄
(4)①B ②浓硫酸具有强氧化性,在碳钢表面形成一层致密的氧化膜,阻止了进一步腐蚀;7.3×10⁻⁴
(1)增大接触面积,加快反应速率,提高浸取率;研钵
(2)2Fe³⁺ + 3CaCO₃ + 3H₂O = 2Fe(OH)₃↓ + 3Ca²⁺ + 3CO₂↑;1:1
(3)MoS₂ + 9NO₃⁻ + 6H⁺ = MoO₄²⁻ + 2SO₄²⁻ + 9NO↑ + 3H₂O;PbSO₄
(4)①B ②浓硫酸具有强氧化性,在碳钢表面形成一层致密的氧化膜,阻止了进一步腐蚀;7.3×10⁻⁴
查看更多完整答案,请扫码查看


