2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第62页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
16.(14分)(2025·河南·二模)草酸钴在化学中应用广泛,可用于制备催化剂等。以钴矿[主要成分为$CoO$、$Co_2O_3$、$Co(OH)_2$,含少量的$SiO_2$、$Al_2O_3$、$FeO$、$MnO_2$等]为原料制取草酸钴晶体$(CoC_2O_4·2H_2O)$的工艺流程如图所示。
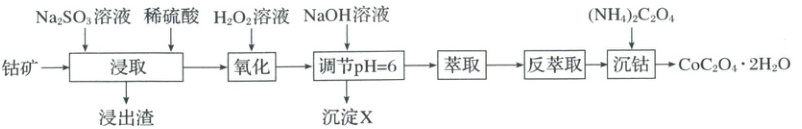
已知:溶液中相关离子沉淀完全$(c\leqslant1.0×10^{-5}mol· L^{-1})$时的pH:
回答下列问题:
(1)Mn在元素周期表中的位置:
(2)“浸取”时$Co_2O_3$发生反应的离子方程式为________。
(3)“氧化”过程中消耗$H_2O_2$的量明显偏高的原因是
(4)在“调节pH=6”的步骤中,沉淀X的成分为:
(5)在“萃取”步骤中,向溶液中加入某有机酸萃取剂$(HA)_2$,发生反应$Co^{2+}+n(HA)_2\rightleftharpoons CoA_2·(n-1)(HA)_2+2H^+$。当溶液pH处于一定范围内时,测得$Co^{2+}$萃取率随溶液pH的增大而增大,其原因是________。
(6)“沉钴”为草酸钴晶体$(CoC_2O_4·2H_2O)$,将54.9g该晶体“灼烧”至质量不再减轻,得到24.1g钴的氧化物,其化学式为



已知:溶液中相关离子沉淀完全$(c\leqslant1.0×10^{-5}mol· L^{-1})$时的pH:
回答下列问题:
(1)Mn在元素周期表中的位置:
第四周期第ⅦB族
,写出Co的价层电子排布式3d74s2
。(2)“浸取”时$Co_2O_3$发生反应的离子方程式为________。
(3)“氧化”过程中消耗$H_2O_2$的量明显偏高的原因是
2H2O2$\xrightarrow{Fe^{3+}}$2H2O+O2↑
(用化学方程式表示)。(4)在“调节pH=6”的步骤中,沉淀X的成分为:
Fe(OH)3、Al(OH)3
。(5)在“萃取”步骤中,向溶液中加入某有机酸萃取剂$(HA)_2$,发生反应$Co^{2+}+n(HA)_2\rightleftharpoons CoA_2·(n-1)(HA)_2+2H^+$。当溶液pH处于一定范围内时,测得$Co^{2+}$萃取率随溶液pH的增大而增大,其原因是________。
(6)“沉钴”为草酸钴晶体$(CoC_2O_4·2H_2O)$,将54.9g该晶体“灼烧”至质量不再减轻,得到24.1g钴的氧化物,其化学式为
Co3O4
。该氧化物晶胞可以看成4个A型和4个B型小单元交替无隙并置而成(如图2)。其中黑球(●)代表Co3+
(填离子符号)。

答案:
16.[答案]
(1)第四周期第 ⅦB 族 $3d^7 4s^2$
(2)$Co_2O_3 + SO_3^{2-} + 4H^+ \longrightarrow 2Co^{2+} + 2H_2O + SO_4^{2-}$
(3)$2H_2O_2 \xrightarrow{Fe^{3+}} 2H_2O + O_2 \uparrow$
(4)$Fe(OH)_3$、$Al(OH)_3$
(5)随着溶液的 $pH$ 增大,$c(H^+)$ 减小,萃取反应平衡向正反应方向移动
(6)$Co_3O_4$ $Co^{3+}$
[分析] 加硫酸溶解后,氢氧化物及部分金属氧化物溶于硫酸,再加入 $Na_2SO_3$ 后,$MnO_2$ 和 $Co_2O_3$ 被还原成 $Mn^{2+}$ 和 $Co^{2+}$,$SiO_2$ 不与硫酸反应,经过滤除去;向滤液中加入 $H_2O_2$,$H_2O_2$ 将 $Fe^{2+}$ 氧化为 $Fe^{3+}$,然后加入 $NaOH$ 调节 $pH$ 值为 6,$Al^{3+}$、$Fe^{3+}$ 转化为氢氧化物沉淀而除去,滤液经萃取和反萃取后,加入 $(NH_4)_2C_2O_4$ 沉钴,得到 $CoC_2O_4 · 2H_2O$。
[解析]
(1)$Mn$ 为 25 号元素,位于第四周期第 ⅦB 族;$Co$ 为 27 号元素,位于第四周期第 Ⅷ 族,其价电子排布式为 $3d^7 4s^2$;
(2)由上述分析可知,“浸取”过程中 $Co_2O_3$ 与硫酸、$Na_2SO_3$ 反应生成 $CoSO_4$ 和 $Na_2SO_4$,离子方程式为 $Co_2O_3 + SO_3^{2-} + 4H^+ \longrightarrow 2Co^{2+} + 2H_2O + SO_4^{2-}$;
(3)“氧化”过程中,生成的 $Fe^{3+}$ 能催化 $H_2O_2$ 分解,反应的化学方程式为 $2H_2O_2 \xrightarrow{Fe^{3+}} 2H_2O + O_2 \uparrow$;
(4)由上述分析可知,沉淀 X 为 $Fe(OH)_3$ 和 $Al(OH)_3$;
(5)随着溶液的 $pH$ 增大,则 $c(H^+)$ 减小,根据萃取反应可知,萃取平衡正向移动,促使 $Co^{2+}$ 萃取率增大;
(6)$54.9 g$ 草酸钴晶体中,$Co$ 的物质的量为 $\frac{54.9 g}{183 g/mol} = 0.3 mol$,根据元素守恒,所得氧化物中 $Co$ 的物质的量为 $0.3 mol$,则氧化物中 $O$ 元素的物质的量为 $\frac{24.1 g - 0.3 mol × 59 g/mol}{16 g/mol} = 0.4 mol$,$n(Co):n(O) = 3:4$,故氧化物的化学式为 $Co_3O_4$;根据化合物元素化合价代数和为 0,可知 $Co_3O_4$ 中有 1 个 $Co^{2+}$ 和 2 个 $Co^{3+}$,则晶胞中 $N(Co^{3+}):N(Co^{2+}):N(O) = 2:1:4$,结合晶胞结构信息,采用均摊法可知,“●”数目为 $4 × (\frac{4 × \frac{1}{8} + 1}{ }) + 4 × (4 × \frac{1}{8}) = 8$,“黑球”数目为 $4 × 4 = 16$,“白球”数目为 $4 × 4 + 4 × 4 = 32$,故“●”代表 $Co^{2+}$,“白球”代表 $O^{2-}$,“黑球”代表 $Co^{3+}$。
(1)第四周期第 ⅦB 族 $3d^7 4s^2$
(2)$Co_2O_3 + SO_3^{2-} + 4H^+ \longrightarrow 2Co^{2+} + 2H_2O + SO_4^{2-}$
(3)$2H_2O_2 \xrightarrow{Fe^{3+}} 2H_2O + O_2 \uparrow$
(4)$Fe(OH)_3$、$Al(OH)_3$
(5)随着溶液的 $pH$ 增大,$c(H^+)$ 减小,萃取反应平衡向正反应方向移动
(6)$Co_3O_4$ $Co^{3+}$
[分析] 加硫酸溶解后,氢氧化物及部分金属氧化物溶于硫酸,再加入 $Na_2SO_3$ 后,$MnO_2$ 和 $Co_2O_3$ 被还原成 $Mn^{2+}$ 和 $Co^{2+}$,$SiO_2$ 不与硫酸反应,经过滤除去;向滤液中加入 $H_2O_2$,$H_2O_2$ 将 $Fe^{2+}$ 氧化为 $Fe^{3+}$,然后加入 $NaOH$ 调节 $pH$ 值为 6,$Al^{3+}$、$Fe^{3+}$ 转化为氢氧化物沉淀而除去,滤液经萃取和反萃取后,加入 $(NH_4)_2C_2O_4$ 沉钴,得到 $CoC_2O_4 · 2H_2O$。
[解析]
(1)$Mn$ 为 25 号元素,位于第四周期第 ⅦB 族;$Co$ 为 27 号元素,位于第四周期第 Ⅷ 族,其价电子排布式为 $3d^7 4s^2$;
(2)由上述分析可知,“浸取”过程中 $Co_2O_3$ 与硫酸、$Na_2SO_3$ 反应生成 $CoSO_4$ 和 $Na_2SO_4$,离子方程式为 $Co_2O_3 + SO_3^{2-} + 4H^+ \longrightarrow 2Co^{2+} + 2H_2O + SO_4^{2-}$;
(3)“氧化”过程中,生成的 $Fe^{3+}$ 能催化 $H_2O_2$ 分解,反应的化学方程式为 $2H_2O_2 \xrightarrow{Fe^{3+}} 2H_2O + O_2 \uparrow$;
(4)由上述分析可知,沉淀 X 为 $Fe(OH)_3$ 和 $Al(OH)_3$;
(5)随着溶液的 $pH$ 增大,则 $c(H^+)$ 减小,根据萃取反应可知,萃取平衡正向移动,促使 $Co^{2+}$ 萃取率增大;
(6)$54.9 g$ 草酸钴晶体中,$Co$ 的物质的量为 $\frac{54.9 g}{183 g/mol} = 0.3 mol$,根据元素守恒,所得氧化物中 $Co$ 的物质的量为 $0.3 mol$,则氧化物中 $O$ 元素的物质的量为 $\frac{24.1 g - 0.3 mol × 59 g/mol}{16 g/mol} = 0.4 mol$,$n(Co):n(O) = 3:4$,故氧化物的化学式为 $Co_3O_4$;根据化合物元素化合价代数和为 0,可知 $Co_3O_4$ 中有 1 个 $Co^{2+}$ 和 2 个 $Co^{3+}$,则晶胞中 $N(Co^{3+}):N(Co^{2+}):N(O) = 2:1:4$,结合晶胞结构信息,采用均摊法可知,“●”数目为 $4 × (\frac{4 × \frac{1}{8} + 1}{ }) + 4 × (4 × \frac{1}{8}) = 8$,“黑球”数目为 $4 × 4 = 16$,“白球”数目为 $4 × 4 + 4 × 4 = 32$,故“●”代表 $Co^{2+}$,“白球”代表 $O^{2-}$,“黑球”代表 $Co^{3+}$。
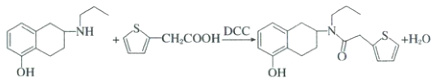
17.(15分)(2025·四川·三模)有机物G是合成某种药物的重要中间体,其合成路线如下:
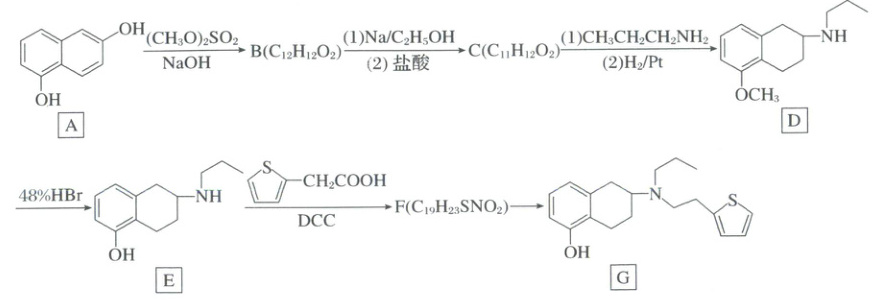

②硫酸二甲酯$[(CH_3O)_2SO_2]$的结构简式为 ;
;
回答下列问题:
(1)B的结构简式为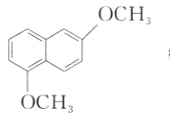 。
。
(2)C中含氧官能团的名称为
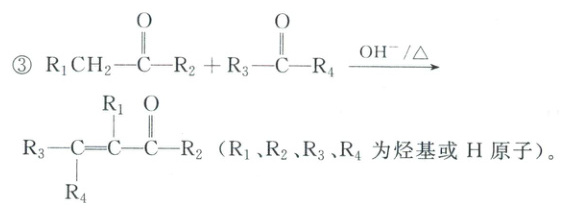
(3)写出$E\to F$的化学方程式:________,该反应的反应类型为________。
(4)有机物K是B的同分异构体,符合下列条件的K的结构有
ⅰ. 不能与$NaOH$溶液反应;
ⅱ. 1molK与足量的金属钠反应能生成22.4L标准状况下的气体;
ⅲ. 含有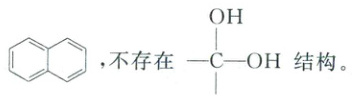
(5)为了减少步骤,缩短反应过程,$D\to G$也可由如下路线合成,结合题示合成路线分析下图中“反应条件”应为
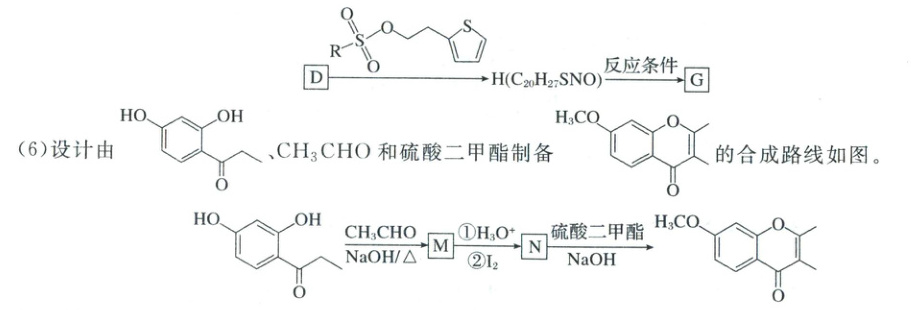
①M分子中不存在手性碳原子,则M的结构简式为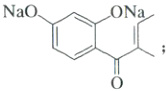 。
。
②N的分子式为
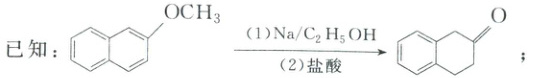


②硫酸二甲酯$[(CH_3O)_2SO_2]$的结构简式为
 ;
;
回答下列问题:
(1)B的结构简式为

(2)C中含氧官能团的名称为
羰基(或酮羰基)、醚键
。(3)写出$E\to F$的化学方程式:________,该反应的反应类型为________。
(4)有机物K是B的同分异构体,符合下列条件的K的结构有
12
种(不考虑立体异构)。ⅰ. 不能与$NaOH$溶液反应;
ⅱ. 1molK与足量的金属钠反应能生成22.4L标准状况下的气体;
ⅲ. 含有

(5)为了减少步骤,缩短反应过程,$D\to G$也可由如下路线合成,结合题示合成路线分析下图中“反应条件”应为
48%HBr
。
①M分子中不存在手性碳原子,则M的结构简式为

②N的分子式为
C8H10O3
。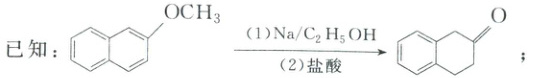
答案:
17.[答案]
(1)
(2)羰基(或酮羰基)、醚键
(3) 取代反应
取代反应
(4)12
(5)$48\% HBr$
(6) G1Ho
G1Ho
[分析] A 发生取代反应生成 B ,B 发生信息 ① 的反应生成 C
,B 发生信息 ① 的反应生成 C  ,C 在一定条件下转化为 D,D 发生取代反应生成 E,E 与
,C 在一定条件下转化为 D,D 发生取代反应生成 E,E 与 $CH_2COOH$ 生成 F
$CH_2COOH$ 生成 F  ,F 转化为 G,据此分析。
,F 转化为 G,据此分析。
[解析]
(1)根据分析可知,B 的结构简式为 ;
;
(2)C 的结构为 ,含氧官能团的名称为羰基(或酮羰基)、醚键;
,含氧官能团的名称为羰基(或酮羰基)、醚键;
(3)E 中氨基与 $CH_2COOH$ 中羧基反应生成酰胺键,E→F 的化学方程式:
$CH_2COOH$ 中羧基反应生成酰胺键,E→F 的化学方程式:
该反应的反应类型为取代反应;
(4)B 的结构简式为 ,K 是 B 的同分异构体,ⅰ.不能与 $NaOH$ 溶液反应,不含有羧基、酚羟基和酯基;ⅱ.$1 mol K$ 与足量的金属钠反应能生成 $22.4 L$ 标准状况下的气体,含有 2 个羟基;ⅲ.含有
,K 是 B 的同分异构体,ⅰ.不能与 $NaOH$ 溶液反应,不含有羧基、酚羟基和酯基;ⅱ.$1 mol K$ 与足量的金属钠反应能生成 $22.4 L$ 标准状况下的气体,含有 2 个羟基;ⅲ.含有 ,不存在
,不存在 —$C—OH$ 结构,① 取代基为两个—$CH_2OH$,
—$C—OH$ 结构,① 取代基为两个—$CH_2OH$,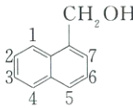
 ,10 种,②取代基为—$CH(OH)CH_2OH$,
,10 种,②取代基为—$CH(OH)CH_2OH$, 有 2 种,共 12 种;
有 2 种,共 12 种;
(5)为了减少步骤,缩短反应过程,D→G 也可由如下路线合成, $H(CH_2SNO)$ 反应应条什件 可逆推,H 为
$H(CH_2SNO)$ 反应应条什件 可逆推,H 为 ,需要将醚键转化为羟基,参考题千中 D 转化为 E,故条件应该为 $48\% HBr$;
,需要将醚键转化为羟基,参考题千中 D 转化为 E,故条件应该为 $48\% HBr$;
(6)①根据已知条件 ③,M 的结构简式为 ,因 M 分子中不存在手性碳原子,则 M 为
,因 M 分子中不存在手性碳原子,则 M 为
② 经反应生成 N (
经反应生成 N ( )分分子式为 $C_8H_{10}O_3$。
)分分子式为 $C_8H_{10}O_3$。
17.[答案]
(1)

(2)羰基(或酮羰基)、醚键
(3)
 取代反应
取代反应(4)12
(5)$48\% HBr$
(6)
 G1Ho
G1Ho[分析] A 发生取代反应生成 B
 ,B 发生信息 ① 的反应生成 C
,B 发生信息 ① 的反应生成 C  ,C 在一定条件下转化为 D,D 发生取代反应生成 E,E 与
,C 在一定条件下转化为 D,D 发生取代反应生成 E,E 与 $CH_2COOH$ 生成 F
$CH_2COOH$ 生成 F  ,F 转化为 G,据此分析。
,F 转化为 G,据此分析。[解析]
(1)根据分析可知,B 的结构简式为
 ;
;(2)C 的结构为
 ,含氧官能团的名称为羰基(或酮羰基)、醚键;
,含氧官能团的名称为羰基(或酮羰基)、醚键;(3)E 中氨基与
 $CH_2COOH$ 中羧基反应生成酰胺键,E→F 的化学方程式:
$CH_2COOH$ 中羧基反应生成酰胺键,E→F 的化学方程式:
该反应的反应类型为取代反应;
(4)B 的结构简式为
 ,K 是 B 的同分异构体,ⅰ.不能与 $NaOH$ 溶液反应,不含有羧基、酚羟基和酯基;ⅱ.$1 mol K$ 与足量的金属钠反应能生成 $22.4 L$ 标准状况下的气体,含有 2 个羟基;ⅲ.含有
,K 是 B 的同分异构体,ⅰ.不能与 $NaOH$ 溶液反应,不含有羧基、酚羟基和酯基;ⅱ.$1 mol K$ 与足量的金属钠反应能生成 $22.4 L$ 标准状况下的气体,含有 2 个羟基;ⅲ.含有 ,不存在
,不存在 —$C—OH$ 结构,① 取代基为两个—$CH_2OH$,
—$C—OH$ 结构,① 取代基为两个—$CH_2OH$,
 ,10 种,②取代基为—$CH(OH)CH_2OH$,
,10 种,②取代基为—$CH(OH)CH_2OH$, 有 2 种,共 12 种;
有 2 种,共 12 种;(5)为了减少步骤,缩短反应过程,D→G 也可由如下路线合成,
 $H(CH_2SNO)$ 反应应条什件 可逆推,H 为
$H(CH_2SNO)$ 反应应条什件 可逆推,H 为 ,需要将醚键转化为羟基,参考题千中 D 转化为 E,故条件应该为 $48\% HBr$;
,需要将醚键转化为羟基,参考题千中 D 转化为 E,故条件应该为 $48\% HBr$;(6)①根据已知条件 ③,M 的结构简式为
 ,因 M 分子中不存在手性碳原子,则 M 为
,因 M 分子中不存在手性碳原子,则 M 为
②
 经反应生成 N (
经反应生成 N ( )分分子式为 $C_8H_{10}O_3$。
)分分子式为 $C_8H_{10}O_3$。 查看更多完整答案,请扫码查看


