2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第69页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
14.(2025·湖北·二模)25℃时,用NaOH标准溶液滴定20.00mL同浓度的三元酸(H₃A)溶液,滴定曲线及溶液中lg X[X代表c(A³⁻)/c(HA²⁻)、c(HA²⁻)/c(H₂A⁻)或c(H₂A⁻)/c(H₃A)]随pH变化曲线如图。下列说法正确的是(
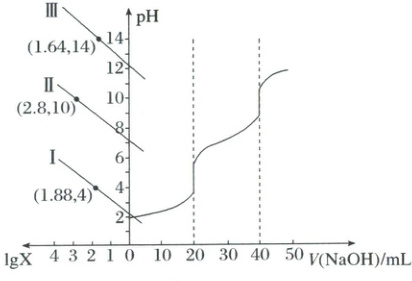
A.曲线Ⅲ表示lg c(H₂A⁻)/c(H₃A)随pH变化曲线
B.当pH=6时,lg c(HA²⁻)/c(H₂A⁻)=-1.2
C.当V(NaOH)=20.00mL时,c(H₂A⁻)>c(H₃A)>c(HA²⁻)
D.当V(NaOH)=40.00mL时,2c(H₃A)+c(H₂A⁻)<c(A³⁻)
B
)
A.曲线Ⅲ表示lg c(H₂A⁻)/c(H₃A)随pH变化曲线
B.当pH=6时,lg c(HA²⁻)/c(H₂A⁻)=-1.2
C.当V(NaOH)=20.00mL时,c(H₂A⁻)>c(H₃A)>c(HA²⁻)
D.当V(NaOH)=40.00mL时,2c(H₃A)+c(H₂A⁻)<c(A³⁻)
答案:
14.[答案] B
[分析] 三元酸$H_3A$的电离常数$K_1>K_2>K_3$,$lgX = 0$时,$\frac{c(A^{3 -})}{c(HA^{2 -})}=\frac{c(HA^{2 -})}{c(H_2A^ -)}=\frac{c(H_2A^ -)}{c(H_3A)}$,对应的$pH$值Ⅰ<Ⅱ<Ⅲ,$H^+$浓度Ⅰ>Ⅱ>Ⅲ,则Ⅰ代表$lg\frac{c(H_2A^ -)}{c(H_3A)}$随$pH$值变化,Ⅱ代表$lg\frac{c(HA^{2 -})}{c(H_2A^ -)}$随$pH$值变化,Ⅲ代表$lg\frac{c(A^{3 -})}{c(HA^{2 -})}$随$pH$值变化。
[解析] A.根据分析,曲线Ⅰ表示$lg\frac{c(H_2A^ -)}{c(H_3A)}$随$pH$变化曲线,A错误;B.根据曲线Ⅱ可知,$lg\frac{c(HA^{2 -})}{c(H_2A^ -)} = 2.8$,$pH = 10$,$c(H^+)=10^{-10}$,$K_2=\frac{c(HA^{2 -})×c(H^+)}{c(H_2A^ -)}=10^{2.8}×10^{-10}=10^{-7.2}$,当$pH = 6$时,$c(H^+)=10^{-6}$,$\frac{c(HA^{2 -})}{c(H_2A^ -)}=\frac{K_2}{c(H^+)}=\frac{10^{-7.2}}{10^{-6}}=10^{-1.2}$,$lg\frac{c(HA^{2 -})}{c(H_2A^ -)}=-1.2$,B正确;C.当$V(NaOH)=20.00mL$时,生成$NaH_2A$,依据图像判断溶液显酸性,$H_2A^ -$的电离程度大于水解程度,则$c(H_2A^ -)>c(HA^{2 -})>c(H_3A)$,C错误;D.当$V(NaOH)=40.00mL$时,生成$Na_2HA$,溶液显碱性,依据电荷守恒:$c(Na^+)+c(H^+)=c(H_2A^ -)+2c(HA^{2 -})+3c(A^{3 -})+c(OH^ -)$,物料守恒:$c(Na^+)=2c(H_3A)+2c(H_2A^ -)+2c(HA^{2 -})+2c(A^{3 -})$,得到$2c(H_3A)+c(H_2A^ -)>c(A^{3 -})$,D错误;答案选B。
[分析] 三元酸$H_3A$的电离常数$K_1>K_2>K_3$,$lgX = 0$时,$\frac{c(A^{3 -})}{c(HA^{2 -})}=\frac{c(HA^{2 -})}{c(H_2A^ -)}=\frac{c(H_2A^ -)}{c(H_3A)}$,对应的$pH$值Ⅰ<Ⅱ<Ⅲ,$H^+$浓度Ⅰ>Ⅱ>Ⅲ,则Ⅰ代表$lg\frac{c(H_2A^ -)}{c(H_3A)}$随$pH$值变化,Ⅱ代表$lg\frac{c(HA^{2 -})}{c(H_2A^ -)}$随$pH$值变化,Ⅲ代表$lg\frac{c(A^{3 -})}{c(HA^{2 -})}$随$pH$值变化。
[解析] A.根据分析,曲线Ⅰ表示$lg\frac{c(H_2A^ -)}{c(H_3A)}$随$pH$变化曲线,A错误;B.根据曲线Ⅱ可知,$lg\frac{c(HA^{2 -})}{c(H_2A^ -)} = 2.8$,$pH = 10$,$c(H^+)=10^{-10}$,$K_2=\frac{c(HA^{2 -})×c(H^+)}{c(H_2A^ -)}=10^{2.8}×10^{-10}=10^{-7.2}$,当$pH = 6$时,$c(H^+)=10^{-6}$,$\frac{c(HA^{2 -})}{c(H_2A^ -)}=\frac{K_2}{c(H^+)}=\frac{10^{-7.2}}{10^{-6}}=10^{-1.2}$,$lg\frac{c(HA^{2 -})}{c(H_2A^ -)}=-1.2$,B正确;C.当$V(NaOH)=20.00mL$时,生成$NaH_2A$,依据图像判断溶液显酸性,$H_2A^ -$的电离程度大于水解程度,则$c(H_2A^ -)>c(HA^{2 -})>c(H_3A)$,C错误;D.当$V(NaOH)=40.00mL$时,生成$Na_2HA$,溶液显碱性,依据电荷守恒:$c(Na^+)+c(H^+)=c(H_2A^ -)+2c(HA^{2 -})+3c(A^{3 -})+c(OH^ -)$,物料守恒:$c(Na^+)=2c(H_3A)+2c(H_2A^ -)+2c(HA^{2 -})+2c(A^{3 -})$,得到$2c(H_3A)+c(H_2A^ -)>c(A^{3 -})$,D错误;答案选B。
15.(14分)(2025·山东淄博·三模)铜、金可形成许多结构与性质特殊的化合物。回答下列问题:
(1)齐文化博物馆汉代器物上的颜料“中国蓝”的成分为BaCuSi₄O₁₀,其基态铜离子的价电子排布式为
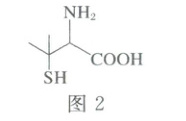
(2)用青霉胺(见图2)可解铜盐中毒,青霉胺分子中S原子的轨道杂化方式为______;键角:H₂S______NH₃(填“>”或“<”);第二周期元素中,第一电离能大于N的元素有______(用元素符号表示);青霉胺易溶于水的主要原因为______。
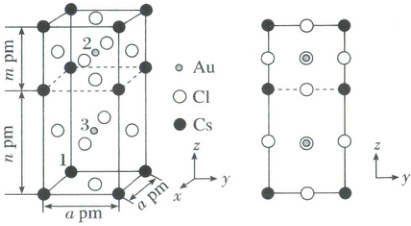
(3)由Au、Cs和Cl组成的晶胞属于四方晶系,结构如图所示,2、3为两种不同价态和化学环境的Au,m<a<n。则两种环境Au的配离子化学式分别为
(1)齐文化博物馆汉代器物上的颜料“中国蓝”的成分为BaCuSi₄O₁₀,其基态铜离子的价电子排布式为
3d⁹
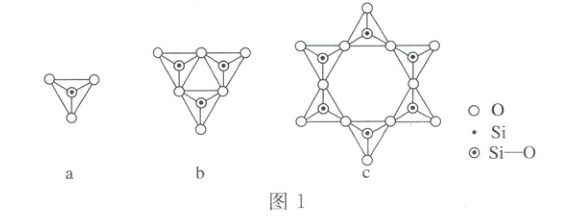
,基态O原子核外电子的空间运动状态有5
种。硅氧四面体SiO₄⁴⁻结构如图a表示,图b和图c分别是由数个SiO₄⁴⁻构成的多硅酸根,若Si原子数为n(n≥3),则其化学式可表示为SiₙO₃ⁿ²⁻
。
(2)用青霉胺(见图2)可解铜盐中毒,青霉胺分子中S原子的轨道杂化方式为______;键角:H₂S______NH₃(填“>”或“<”);第二周期元素中,第一电离能大于N的元素有______(用元素符号表示);青霉胺易溶于水的主要原因为______。

(3)由Au、Cs和Cl组成的晶胞属于四方晶系,结构如图所示,2、3为两种不同价态和化学环境的Au,m<a<n。则两种环境Au的配离子化学式分别为
[AuCl₂]⁻、[AuCl₄]⁻
。点1原子的分数坐标为(0,0,0),则点2原子的分数坐标为($\frac{1}{2}$,$\frac{1}{2}$,$\frac{n + 0.5m}{m + n}$)
。
答案:
15.[答案]
(1)$3d^9$ 5 $Si_nO^{2n -}_3$
(2)$sp^3$ < $F$、$Ne$ 青霉胺可与水形成分子间氢键
(3)$[AuCl_2]^ -$、$[AuCl_4]^ -$ $(\frac{1}{2},\frac{1}{2},\frac{n + 0.5m}{m + n})$
[解析]
(1)①$Cu$原子电子排布式为$[Ar]3d^{10}4s^1$,$Cu^{2 +}$其价层电子排布式为$3d^9$;②基态$O$原子核外电子排布式为$1s^22s^22p^4$,$s$轨道和$p$轨道的原子轨道数共为5,则基态$O$的空间运动状态有5种;③$c$中含有6个四面体结构,所以含有6个$Si$原子,含有的氧原子数为18,含有氧原子数比6个$SiO_3^{2 -}$少6个$O$,带有的电荷数为:$6×(-2)= - 12$;根据图示可知:若一个单环状离子中$Si$原子数为$n(n\geq3)$,则含有$n$个四面体结构,含有的氧原子数目比$n$个硅酸根离子恰好少$n$个$O$原子,即:含有$n$个$Si$原子,则含有$3n$个氧原子,带有的负电荷为:$n×(-2)= - 2n$,故其化学式为:$Si_nO^{2n -}_3$;
(2)①由图2可知青霉胺的结构简式为 ,$S$原子的价层电子对数为4,故$S$原子轨道杂化方式为$sp^3$;②$H_2S$和$NH_3$中心原子的杂化方式均为$sp^3$杂化,但由于$H_2S$中含有两对孤电子对,而$NH_3$中只含一对孤电子对,含孤电子对数越多则键角就越小,故键角:$H_2S<NH_3$;③第二周期元素中,第一电离能大于$N$的元素有$F$、$Ne$;④由图
,$S$原子的价层电子对数为4,故$S$原子轨道杂化方式为$sp^3$;②$H_2S$和$NH_3$中心原子的杂化方式均为$sp^3$杂化,但由于$H_2S$中含有两对孤电子对,而$NH_3$中只含一对孤电子对,含孤电子对数越多则键角就越小,故键角:$H_2S<NH_3$;③第二周期元素中,第一电离能大于$N$的元素有$F$、$Ne$;④由图 可知,青霉胺中含有氨基和羧基,它们可与水形成氢键,故易溶于水的主要原因为:青霉胺可与水形成分子间氢键;
可知,青霉胺中含有氨基和羧基,它们可与水形成氢键,故易溶于水的主要原因为:青霉胺可与水形成分子间氢键;
(3)①因为$m < a < n$所以距离点2($Au$)的最近的$Cl^ -$有:上面的面心和中间体内的$Cl^ -$,故点2($Au$)的配离子化学式为$[AuCl_2]^ -$;距离点2($Au$)的最近的$Cl^ -$有:下面六面体的前后左右四个面的面心位置的$Cl^ -$,故点3($Au$)的配离子化学式为$[AuCl_4]^ -$;②分数坐标是指$x$、$y$、$z$三个方向上的距离分别占晶胞长宽高的比例,如图所示,晶胞内部点2位于上面立方体的体心位置,以原子1为原点建立坐标系,小白球位于上部分的体心,高为$m + n$,则小白球的分数坐标为:$(\frac{1}{2},\frac{1}{2},\frac{n + 0.5m}{m + n})$。
15.[答案]
(1)$3d^9$ 5 $Si_nO^{2n -}_3$
(2)$sp^3$ < $F$、$Ne$ 青霉胺可与水形成分子间氢键
(3)$[AuCl_2]^ -$、$[AuCl_4]^ -$ $(\frac{1}{2},\frac{1}{2},\frac{n + 0.5m}{m + n})$
[解析]
(1)①$Cu$原子电子排布式为$[Ar]3d^{10}4s^1$,$Cu^{2 +}$其价层电子排布式为$3d^9$;②基态$O$原子核外电子排布式为$1s^22s^22p^4$,$s$轨道和$p$轨道的原子轨道数共为5,则基态$O$的空间运动状态有5种;③$c$中含有6个四面体结构,所以含有6个$Si$原子,含有的氧原子数为18,含有氧原子数比6个$SiO_3^{2 -}$少6个$O$,带有的电荷数为:$6×(-2)= - 12$;根据图示可知:若一个单环状离子中$Si$原子数为$n(n\geq3)$,则含有$n$个四面体结构,含有的氧原子数目比$n$个硅酸根离子恰好少$n$个$O$原子,即:含有$n$个$Si$原子,则含有$3n$个氧原子,带有的负电荷为:$n×(-2)= - 2n$,故其化学式为:$Si_nO^{2n -}_3$;
(2)①由图2可知青霉胺的结构简式为
 ,$S$原子的价层电子对数为4,故$S$原子轨道杂化方式为$sp^3$;②$H_2S$和$NH_3$中心原子的杂化方式均为$sp^3$杂化,但由于$H_2S$中含有两对孤电子对,而$NH_3$中只含一对孤电子对,含孤电子对数越多则键角就越小,故键角:$H_2S<NH_3$;③第二周期元素中,第一电离能大于$N$的元素有$F$、$Ne$;④由图
,$S$原子的价层电子对数为4,故$S$原子轨道杂化方式为$sp^3$;②$H_2S$和$NH_3$中心原子的杂化方式均为$sp^3$杂化,但由于$H_2S$中含有两对孤电子对,而$NH_3$中只含一对孤电子对,含孤电子对数越多则键角就越小,故键角:$H_2S<NH_3$;③第二周期元素中,第一电离能大于$N$的元素有$F$、$Ne$;④由图 可知,青霉胺中含有氨基和羧基,它们可与水形成氢键,故易溶于水的主要原因为:青霉胺可与水形成分子间氢键;
可知,青霉胺中含有氨基和羧基,它们可与水形成氢键,故易溶于水的主要原因为:青霉胺可与水形成分子间氢键;(3)①因为$m < a < n$所以距离点2($Au$)的最近的$Cl^ -$有:上面的面心和中间体内的$Cl^ -$,故点2($Au$)的配离子化学式为$[AuCl_2]^ -$;距离点2($Au$)的最近的$Cl^ -$有:下面六面体的前后左右四个面的面心位置的$Cl^ -$,故点3($Au$)的配离子化学式为$[AuCl_4]^ -$;②分数坐标是指$x$、$y$、$z$三个方向上的距离分别占晶胞长宽高的比例,如图所示,晶胞内部点2位于上面立方体的体心位置,以原子1为原点建立坐标系,小白球位于上部分的体心,高为$m + n$,则小白球的分数坐标为:$(\frac{1}{2},\frac{1}{2},\frac{n + 0.5m}{m + n})$。
查看更多完整答案,请扫码查看


