2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第14页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
10.第十五届中国国际航空航天博览会,以粉煤加压气化技术为核心的全新一代全废锅气化炉在航展上展
出。粉煤加压气化技术广泛用于煤制甲醇、合成氨、合成油、制烯烃、制氢等领域。粉煤加压气化制氢
时发生的主要反应如下:
Ⅰ.C(s)+H2O(g)CO(g)+H2(g) △H1=+131.3kJ.mol−1;
I[.C(s)+2H2O(g)CO2(g)+2H2(g) △H2=+90.3kJ.mol−1;
Ⅲ.CO(g)+H2O(g)CO2(g)+H2(g) △H3。
将足量的碳和2molH2O(g)充入一恒容密闭容器中发生上述反应,假设TC时2molH2O(g)在该容
器中产生的压强为Po。达到平衡时,H2O(g)的转化率和容器中混合气体的平均相对分子质量随温度
的变化如图所示。
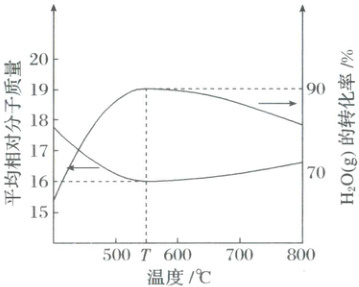
下列说法错误的是 (
A.CO(g)+H2O(g)CO2(g)+H2(g) △H3=−41kJ.mol1−1
B.温度大于T℃时,以反应III为主,导致平衡时混合气体的平均相对分子质量变化程度较小
C.T℃时,假设体系中只发生反应I和反应II,反应I的平衡常数Kp=0.9po
D.在相同温度条件下,改变容器容积维持压强为Po,达到平衡时所得H2含量会更低
出。粉煤加压气化技术广泛用于煤制甲醇、合成氨、合成油、制烯烃、制氢等领域。粉煤加压气化制氢
时发生的主要反应如下:
Ⅰ.C(s)+H2O(g)CO(g)+H2(g) △H1=+131.3kJ.mol−1;
I[.C(s)+2H2O(g)CO2(g)+2H2(g) △H2=+90.3kJ.mol−1;
Ⅲ.CO(g)+H2O(g)CO2(g)+H2(g) △H3。
将足量的碳和2molH2O(g)充入一恒容密闭容器中发生上述反应,假设TC时2molH2O(g)在该容
器中产生的压强为Po。达到平衡时,H2O(g)的转化率和容器中混合气体的平均相对分子质量随温度
的变化如图所示。

下列说法错误的是 (
D
)A.CO(g)+H2O(g)CO2(g)+H2(g) △H3=−41kJ.mol1−1
B.温度大于T℃时,以反应III为主,导致平衡时混合气体的平均相对分子质量变化程度较小
C.T℃时,假设体系中只发生反应I和反应II,反应I的平衡常数Kp=0.9po
D.在相同温度条件下,改变容器容积维持压强为Po,达到平衡时所得H2含量会更低
答案:
10.[答案] D
[解析] 根据盖斯定律可知,反应Ⅲ = 反应Ⅱ - 反应Ⅰ,则CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g) ΔH₃ = ΔH₂ - ΔH₁ = +90.3kJ·mol⁻¹ - (+131.3kJ·mol⁻¹) = -41kJ·mol⁻¹,A正确。由题意可知,反应Ⅰ、Ⅱ为吸热反应,反应Ⅲ为放热反应,结合题图可知,反应温度小于T℃时,H₂O(g)的平衡转化率随温度升高而增大,即升高温度,平衡正向移动,说明主要发生反应Ⅰ、Ⅱ;温度大于T℃时,H₂O(g)的平衡转化率随温度升高而减小,即升高温度,平衡逆向移动,说明主要发生反应Ⅲ,反应Ⅲ是反应前后气体分子数不变的反应,故平衡时混合气体平均相对分子质量变化程度较小,B正确。如果T℃时体系中只发生反应Ⅰ和反应Ⅱ,由题图可知,达到平衡时,混合气体的平均相对分子质量为16,H₂O(g)的转化率为90%,初始时n(H₂O) = 2mol,则n_平(H₂O) = 0.2mol,n_平(H₂) = 1.8mol,n_平(CO) + 2n_平(CO₂) = 1.8mol,设n_平(CO) = xmol,则n_平$(CO₂) = \frac{1.8 - x}{2}mol,$平衡时体系中混合气体的总质量$m = [18×0.2 + 2×1.8 + 28x + 44×\frac{1.8 - x}{2}]g = (46.8 + 6x)g,$总物质的量n_平$ = 0.2mol + 1.8mol + xmol + \frac{1.8 - x}{2}mol = (2.9 + 0.5x)mol,$故该混合气体的摩尔质量为$\frac{m}{n_平} = \frac{46.8 + 6x}{2.9 + 0.5x}g·mol⁻¹ = 16g·mol⁻¹,$解得x = 0.2,故n_平(CO) = 0.2mol,则n_平(CO₂) = 0.8mol,n_总 = 3mol,由题意知,T℃时恒容密闭容器中2molH₂O(g)的压强为p₀,结合恒温恒容条件下气体的物质的量之比等于其压强之比可知,平衡时容器内总压强为1.5p₀,则平衡时p(H₂O) = 0.1p₀,p(H₂) = 0.9p₀,p(CO) = 0.1p₀,故反应Ⅰ的平衡常数$K_p = \frac$</think></think>p(CO)·p(H₂)}{p(H₂O)} = 0.9p₀,C正确。反应Ⅰ、Ⅱ是反应前后气体分子数增大的反应,反应Ⅲ是反应前后气体分子数不变的反应,根据恒温恒容条件下气体的物质的量之比等于其压强之比可知,反应达到平衡时容器内压强增大,若在相同温度条件下,改变容器容积维持压强为p₀,相对于原平衡即增大容器容积、减小压强,反应Ⅰ、Ⅱ的平衡正向移动,则达到新平衡时所得H₂含量会更高,D错误。
[解析] 根据盖斯定律可知,反应Ⅲ = 反应Ⅱ - 反应Ⅰ,则CO(g) + H₂O(g) ⇌ CO₂(g) + H₂(g) ΔH₃ = ΔH₂ - ΔH₁ = +90.3kJ·mol⁻¹ - (+131.3kJ·mol⁻¹) = -41kJ·mol⁻¹,A正确。由题意可知,反应Ⅰ、Ⅱ为吸热反应,反应Ⅲ为放热反应,结合题图可知,反应温度小于T℃时,H₂O(g)的平衡转化率随温度升高而增大,即升高温度,平衡正向移动,说明主要发生反应Ⅰ、Ⅱ;温度大于T℃时,H₂O(g)的平衡转化率随温度升高而减小,即升高温度,平衡逆向移动,说明主要发生反应Ⅲ,反应Ⅲ是反应前后气体分子数不变的反应,故平衡时混合气体平均相对分子质量变化程度较小,B正确。如果T℃时体系中只发生反应Ⅰ和反应Ⅱ,由题图可知,达到平衡时,混合气体的平均相对分子质量为16,H₂O(g)的转化率为90%,初始时n(H₂O) = 2mol,则n_平(H₂O) = 0.2mol,n_平(H₂) = 1.8mol,n_平(CO) + 2n_平(CO₂) = 1.8mol,设n_平(CO) = xmol,则n_平$(CO₂) = \frac{1.8 - x}{2}mol,$平衡时体系中混合气体的总质量$m = [18×0.2 + 2×1.8 + 28x + 44×\frac{1.8 - x}{2}]g = (46.8 + 6x)g,$总物质的量n_平$ = 0.2mol + 1.8mol + xmol + \frac{1.8 - x}{2}mol = (2.9 + 0.5x)mol,$故该混合气体的摩尔质量为$\frac{m}{n_平} = \frac{46.8 + 6x}{2.9 + 0.5x}g·mol⁻¹ = 16g·mol⁻¹,$解得x = 0.2,故n_平(CO) = 0.2mol,则n_平(CO₂) = 0.8mol,n_总 = 3mol,由题意知,T℃时恒容密闭容器中2molH₂O(g)的压强为p₀,结合恒温恒容条件下气体的物质的量之比等于其压强之比可知,平衡时容器内总压强为1.5p₀,则平衡时p(H₂O) = 0.1p₀,p(H₂) = 0.9p₀,p(CO) = 0.1p₀,故反应Ⅰ的平衡常数$K_p = \frac$</think></think>p(CO)·p(H₂)}{p(H₂O)} = 0.9p₀,C正确。反应Ⅰ、Ⅱ是反应前后气体分子数增大的反应,反应Ⅲ是反应前后气体分子数不变的反应,根据恒温恒容条件下气体的物质的量之比等于其压强之比可知,反应达到平衡时容器内压强增大,若在相同温度条件下,改变容器容积维持压强为p₀,相对于原平衡即增大容器容积、减小压强,反应Ⅰ、Ⅱ的平衡正向移动,则达到新平衡时所得H₂含量会更高,D错误。
查看更多完整答案,请扫码查看


