2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第32页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
4. 二氧化钒(VO₂)是一种新型热敏材料,实验室以V₂O₅为原料合成用于制备VO₂的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为(NH₄)₅[(VO)₆(CO₃)₄(OH)₉]·10H₂O},过程如下:
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)步骤ⅰ中生成VOCl₂同时生成N₂的化学方程式为______。常温下,只用浓盐酸与V₂O₅反应也能制备VOCl₂溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是______(用化学方程式和必要的文字说明)。
(2)步骤ⅱ可用下图仪器组装完成。
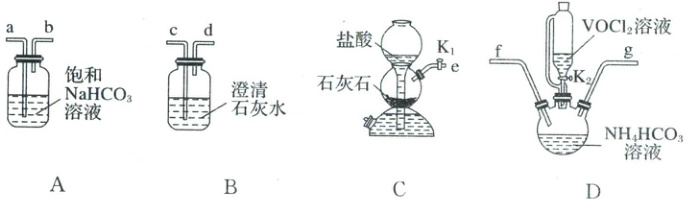
①上述装置从左到右的连接顺序为______(用各接口字母表示)。
②饱和NaHCO₃溶液的作用是______。
③反应结束后,将三颈烧瓶置于CO₂保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和NH₄HCO₃溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH₄HCO₃溶液洗涤除去的阴离子主要是
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:

粗产品wg→20mL水、30mL稀硫酸→稍过量的0.1mol·L⁻¹KMnO₄溶液→稍过量的1%NaNO₂溶液→适量的尿素溶液→1mol·L⁻¹(NH₄)₂Fe(SO₄)₂溶液滴定至终点→再重复实验两次
消耗(NH₄)₂Fe(SO₄)₂溶液的体积如下:

滴定反应为VO₂⁺ + Fe²⁺ + 2H⁺ = VO²⁺ + Fe³⁺ + H₂O。
①滴定时,向锥形瓶中加入几滴
②粗产品中钒的质量分数为
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)步骤ⅰ中生成VOCl₂同时生成N₂的化学方程式为______。常温下,只用浓盐酸与V₂O₅反应也能制备VOCl₂溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是______(用化学方程式和必要的文字说明)。
(2)步骤ⅱ可用下图仪器组装完成。

①上述装置从左到右的连接顺序为______(用各接口字母表示)。
②饱和NaHCO₃溶液的作用是______。
③反应结束后,将三颈烧瓶置于CO₂保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和NH₄HCO₃溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH₄HCO₃溶液洗涤除去的阴离子主要是
$\begin{array}{c} \vdots \mathrm{Cl} \vdots \\ {-} \end{array}$
(填阴离子的电子式)。(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:

粗产品wg→20mL水、30mL稀硫酸→稍过量的0.1mol·L⁻¹KMnO₄溶液→稍过量的1%NaNO₂溶液→适量的尿素溶液→1mol·L⁻¹(NH₄)₂Fe(SO₄)₂溶液滴定至终点→再重复实验两次
消耗(NH₄)₂Fe(SO₄)₂溶液的体积如下:

滴定反应为VO₂⁺ + Fe²⁺ + 2H⁺ = VO²⁺ + Fe³⁺ + H₂O。
①滴定时,向锥形瓶中加入几滴
K₃[Fe(CN)₆]
(填化学式)溶液作指示剂。②粗产品中钒的质量分数为
$\frac{102}{w}$
%。
答案:
(1)${2V2O5 + N2H4 + 8HCl \xlongequal{\triangle} 4VOCl2 + N2↑ + 6H2O}$ ${V2O5 + 6HCl(浓) = 2VOCl2 + Cl2↑ + 3H2O}$,产生有毒气体Cl₂,会污染环境
(2)①eabfgc ②除去CO₂中混有的HCl气体
③\begin{array}{c} \vdots \mathrm{Cl} \vdots \\ {-} \end{array}
(3)①K₃[Fe(CN)₆] ②$\frac{102}{w}$
[解析]
(2)① + 4价钒在弱酸性条件下具有还原性,因此在反应前需要除尽装置内的空气,先用C装置产生CO₂,生成的CO₂中混有HCl,故再将混合气体通过A除去CO₂中的HCl,然后连接D装置,最后g连接c,观察到澄清石灰水变浑浊说明装置内的空气已经排尽,故从左到右的连接顺序为eabfgc。③VOCl₂与NH₄HCO₃反应生成氧钒(Ⅳ)碱式碳酸铵晶体,反应后的溶液中含有氯离子,过滤后得到紫红色晶体,用饱和碳酸氢铵溶液洗涤除去晶体表面的氯离子,氯离子的电子式为 \begin{array}{c} \vdots \mathrm{Cl} \vdots \\ {-} \end{array}。
(3)粗产品中加入稀硫酸生成VO²⁺,再加入酸性高锰酸钾溶液将VO²⁺氧化成VO₂⁺,充分反应后加入NaNO₂除去过量的高锰酸钾,最后用硫酸亚铁铵滴定含VO₂⁺的溶液。①用硫酸亚铁铵滴定含VO₂⁺的溶液,滴定终点时Fe²⁺稍过量,可选用K₃[Fe(CN)₆]作指示剂。②根据三组实验的数据,消耗硫酸亚铁铵溶液的体积平均值为20mL,亚铁离子物质的量为0.02mol,根据方程式VO₂⁺ + Fe²⁺ + 2H⁺ = VO²⁺ + Fe³⁺ + H₂O可知,VO₂⁺的物质的量为0.02mol,根据V守恒可知,样品中含有0.02molV,故粗产品中V的质量分数为 $\frac{0.02 mol×51 g·mol⁻¹}{w g}$×100% = $\frac{102}{w}$%。
(1)${2V2O5 + N2H4 + 8HCl \xlongequal{\triangle} 4VOCl2 + N2↑ + 6H2O}$ ${V2O5 + 6HCl(浓) = 2VOCl2 + Cl2↑ + 3H2O}$,产生有毒气体Cl₂,会污染环境
(2)①eabfgc ②除去CO₂中混有的HCl气体
③\begin{array}{c} \vdots \mathrm{Cl} \vdots \\ {-} \end{array}
(3)①K₃[Fe(CN)₆] ②$\frac{102}{w}$
[解析]
(2)① + 4价钒在弱酸性条件下具有还原性,因此在反应前需要除尽装置内的空气,先用C装置产生CO₂,生成的CO₂中混有HCl,故再将混合气体通过A除去CO₂中的HCl,然后连接D装置,最后g连接c,观察到澄清石灰水变浑浊说明装置内的空气已经排尽,故从左到右的连接顺序为eabfgc。③VOCl₂与NH₄HCO₃反应生成氧钒(Ⅳ)碱式碳酸铵晶体,反应后的溶液中含有氯离子,过滤后得到紫红色晶体,用饱和碳酸氢铵溶液洗涤除去晶体表面的氯离子,氯离子的电子式为 \begin{array}{c} \vdots \mathrm{Cl} \vdots \\ {-} \end{array}。
(3)粗产品中加入稀硫酸生成VO²⁺,再加入酸性高锰酸钾溶液将VO²⁺氧化成VO₂⁺,充分反应后加入NaNO₂除去过量的高锰酸钾,最后用硫酸亚铁铵滴定含VO₂⁺的溶液。①用硫酸亚铁铵滴定含VO₂⁺的溶液,滴定终点时Fe²⁺稍过量,可选用K₃[Fe(CN)₆]作指示剂。②根据三组实验的数据,消耗硫酸亚铁铵溶液的体积平均值为20mL,亚铁离子物质的量为0.02mol,根据方程式VO₂⁺ + Fe²⁺ + 2H⁺ = VO²⁺ + Fe³⁺ + H₂O可知,VO₂⁺的物质的量为0.02mol,根据V守恒可知,样品中含有0.02molV,故粗产品中V的质量分数为 $\frac{0.02 mol×51 g·mol⁻¹}{w g}$×100% = $\frac{102}{w}$%。
查看更多完整答案,请扫码查看


