2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第59页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
9.(2025·湖南长沙·二模)钙镁矿、$FeSO_4·6H_2O$、$CO_2$的结构模型如图所示。下列说法错误的是(
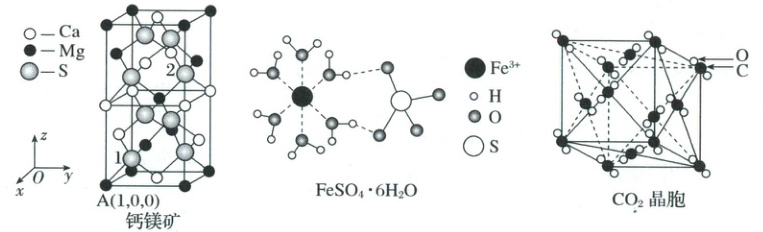
A.钙镁矿中,1号原子的分数坐标为:$(\dfrac{3}{4},\dfrac{1}{4},\dfrac{1}{8})$,2号原子的分数坐标为$(\dfrac{1}{4},\dfrac{3}{4},\dfrac{5}{8})$
B.钙镁矿中,距离硫原子最近的硫原子数目为4
C.$FeSO_4·6H_2O$结构中$H_2O$与$Fe^{2+}$、$H_2O$与$SO_4^{2-}$之间的作用力不相同
D.$CO_2$晶胞中,$CO_2$分子的排列方式有4种取向
B
)
A.钙镁矿中,1号原子的分数坐标为:$(\dfrac{3}{4},\dfrac{1}{4},\dfrac{1}{8})$,2号原子的分数坐标为$(\dfrac{1}{4},\dfrac{3}{4},\dfrac{5}{8})$
B.钙镁矿中,距离硫原子最近的硫原子数目为4
C.$FeSO_4·6H_2O$结构中$H_2O$与$Fe^{2+}$、$H_2O$与$SO_4^{2-}$之间的作用力不相同
D.$CO_2$晶胞中,$CO_2$分子的排列方式有4种取向
答案:
9.[答案] B
[解析] A.分数坐标以晶胞边长为单位 1,1 号原子在 $x$ 轴 $\frac{3}{4}$、$y$ 轴 $\frac{1}{4}$、$z$ 轴 $\frac{1}{8}$ 处,2 号原子在 $x$ 轴 $\frac{1}{4}$、$y$ 轴 $\frac{3}{4}$、$z$ 轴 $\frac{5}{8}$ 处,结合晶胞坐标系的坐标原点及顶点 A 的坐标 $(1,0,0)$,可知钙镁矿中,1 号原子的分数坐标为:$(\frac{3}{4},\frac{1}{4},\frac{1}{8})$,2 号原子的分数坐标为 $(\frac{1}{4},\frac{3}{4},\frac{5}{8})$,A 正确;B.以硫原子为顶点,构成的立方晶胞结构中硫原子的位置位于顶点和面心,所以距离硫原子最近的硫原子数目为 12,B 错误;C.在 $FeSO_4 · 6H_2O$ 晶体中,中心 $Fe^{2+}$ 与 $H_2O$ 的 $O$ 间以配位键结合,配位键属于共价键;而 $H_2O$ 与 $SO_4^{2-}$ 间是 $H_2O$ 的 $H$ 原子与 $SO_4^{2-}$ 的 $O$ 原子之间以氢键结合,氢键属于分子间作用力,可见二者之间的作用力类型不同,C 正确;D.固态二氧化碳俗称干冰。$CO_2$ 在固态时为分子晶体,$CO_2$ 晶胞为面心立方结构,$CO_2$ 分子为直线型。在干冰晶体中二氧化碳分子的排列方向有 4 种,即在顶点上 1 种,3 对面心上 3 种,即排列方式有 4 种取向,D 正确;故合理选项是 B。
[解析] A.分数坐标以晶胞边长为单位 1,1 号原子在 $x$ 轴 $\frac{3}{4}$、$y$ 轴 $\frac{1}{4}$、$z$ 轴 $\frac{1}{8}$ 处,2 号原子在 $x$ 轴 $\frac{1}{4}$、$y$ 轴 $\frac{3}{4}$、$z$ 轴 $\frac{5}{8}$ 处,结合晶胞坐标系的坐标原点及顶点 A 的坐标 $(1,0,0)$,可知钙镁矿中,1 号原子的分数坐标为:$(\frac{3}{4},\frac{1}{4},\frac{1}{8})$,2 号原子的分数坐标为 $(\frac{1}{4},\frac{3}{4},\frac{5}{8})$,A 正确;B.以硫原子为顶点,构成的立方晶胞结构中硫原子的位置位于顶点和面心,所以距离硫原子最近的硫原子数目为 12,B 错误;C.在 $FeSO_4 · 6H_2O$ 晶体中,中心 $Fe^{2+}$ 与 $H_2O$ 的 $O$ 间以配位键结合,配位键属于共价键;而 $H_2O$ 与 $SO_4^{2-}$ 间是 $H_2O$ 的 $H$ 原子与 $SO_4^{2-}$ 的 $O$ 原子之间以氢键结合,氢键属于分子间作用力,可见二者之间的作用力类型不同,C 正确;D.固态二氧化碳俗称干冰。$CO_2$ 在固态时为分子晶体,$CO_2$ 晶胞为面心立方结构,$CO_2$ 分子为直线型。在干冰晶体中二氧化碳分子的排列方向有 4 种,即在顶点上 1 种,3 对面心上 3 种,即排列方式有 4 种取向,D 正确;故合理选项是 B。
10.(2025·福建福州·二模)碱式碳酸锌$[Zn_3(OH)_4CO_3]$广泛应用于橡胶、塑料等行业。以含锌废液(主要成分为$ZnSO_4$,含少量的$Fe^{2+}$和$Mn^{2+}$)为原料制备碱式碳酸锌的流程如下:
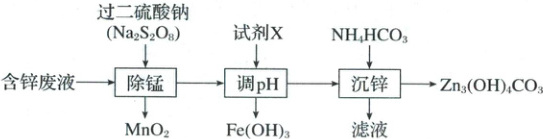
下列说法正确的是()
A.“除锰”时,$S_2O_8^{2-}$的氧化产物为$SO_4^{2-}$
B.“试剂X”可以是$ZnO$或$Fe_2O_3$
C.“沉锌”时,消耗的$Zn^{2+}$和$HCO_3^-$的物质的量之比为1:2
D.过滤后可以依次用稀氨水、乙醇洗涤$Zn_3(OH)_4CO_3$

下列说法正确的是()
A.“除锰”时,$S_2O_8^{2-}$的氧化产物为$SO_4^{2-}$
B.“试剂X”可以是$ZnO$或$Fe_2O_3$
C.“沉锌”时,消耗的$Zn^{2+}$和$HCO_3^-$的物质的量之比为1:2
D.过滤后可以依次用稀氨水、乙醇洗涤$Zn_3(OH)_4CO_3$
答案:
10.[答案] C
[分析] 含锌废液(主要成分为 $ZnSO_4$,含少量的 $Fe^{2+}$ 和 $Mn^{2+}$)加入过二硫酸钠除锰,锰离子被氧化为二氧化锰,过滤除去,同时亚铁离子被氧化为铁离子,然后加入试剂 X 调节 $pH$,X 可以为 $ZnO$ 或 $Zn(OH)_2$,不引入其他杂质,使铁离子转化为氢氧化铁过滤除去,滤液加入碳酸氢铵使锌离子转化为 $Zn_3(OH)_4CO_3$,过滤后的滤液中溶质主要是硫酸铵,据此解答。
[解析] A.“除锰”时,$Mn^{2+}$ 被氧化为 $MnO_2$,则 $S_2O_8^{2-}$ 作氧化剂,发生还原反应。$S_2O_8^{2-}$ 中过氧键的 $O$ 为 $-1$ 价,反应后变为 $SO_4^{2-}$ 中 $-2$ 价的 $O$,故 $SO_4^{2-}$ 是还原产物,而非氧化产物,A 错误;B.“调 $pH$”目的是沉淀 $Fe^{3+}$,试剂 X 需能消耗 $H^+$ 且不引入新杂质。$ZnO$ 与 $H^+$ 反应生成 $Zn^{2+}$(无新杂质),而 $Fe_2O_3$ 与 $H^+$ 反应生成 $Fe^{3+}$,无法达到除去 $Fe^{3+}$ 的目的,B 错误;C.“沉锌”生成 $Zn_3(OH)_4CO_3$,反应的离子方程式为 $3Zn^{2+} + 6HCO_3^- \longrightarrow Zn_3(OH)_4CO_3 \downarrow + H_2O + 5CO_2 \uparrow$,则消耗锌离子和碳酸氢根离子的物质的量之比为 $1:2$,C 正确;D.$Zn_3(OH)_4CO_3$ 中的 $Zn(OH)_2$ 易与氨水反应生成 $[Zn(NH_3)_4]^{2+}$ 而溶解,稀氨水洗涤会导致产品损失,D 错误;故选 C。
[分析] 含锌废液(主要成分为 $ZnSO_4$,含少量的 $Fe^{2+}$ 和 $Mn^{2+}$)加入过二硫酸钠除锰,锰离子被氧化为二氧化锰,过滤除去,同时亚铁离子被氧化为铁离子,然后加入试剂 X 调节 $pH$,X 可以为 $ZnO$ 或 $Zn(OH)_2$,不引入其他杂质,使铁离子转化为氢氧化铁过滤除去,滤液加入碳酸氢铵使锌离子转化为 $Zn_3(OH)_4CO_3$,过滤后的滤液中溶质主要是硫酸铵,据此解答。
[解析] A.“除锰”时,$Mn^{2+}$ 被氧化为 $MnO_2$,则 $S_2O_8^{2-}$ 作氧化剂,发生还原反应。$S_2O_8^{2-}$ 中过氧键的 $O$ 为 $-1$ 价,反应后变为 $SO_4^{2-}$ 中 $-2$ 价的 $O$,故 $SO_4^{2-}$ 是还原产物,而非氧化产物,A 错误;B.“调 $pH$”目的是沉淀 $Fe^{3+}$,试剂 X 需能消耗 $H^+$ 且不引入新杂质。$ZnO$ 与 $H^+$ 反应生成 $Zn^{2+}$(无新杂质),而 $Fe_2O_3$ 与 $H^+$ 反应生成 $Fe^{3+}$,无法达到除去 $Fe^{3+}$ 的目的,B 错误;C.“沉锌”生成 $Zn_3(OH)_4CO_3$,反应的离子方程式为 $3Zn^{2+} + 6HCO_3^- \longrightarrow Zn_3(OH)_4CO_3 \downarrow + H_2O + 5CO_2 \uparrow$,则消耗锌离子和碳酸氢根离子的物质的量之比为 $1:2$,C 正确;D.$Zn_3(OH)_4CO_3$ 中的 $Zn(OH)_2$ 易与氨水反应生成 $[Zn(NH_3)_4]^{2+}$ 而溶解,稀氨水洗涤会导致产品损失,D 错误;故选 C。
11.(2025·甘肃白银·模拟预测)某研究团队开发出一种新型的固态电池(SSBs)他们先将纤维素与邻苯二甲酸酐转化为纤维素邻苯二甲酸酯大分子(CP),再将CP与锂盐混合,形成固体电解质体系(CP-SSE),该电池放电时的工作原理如图所示。下列说法错误的是(

A.利用纤维素制备CP-SSE符合可持续发展要求
B.CP分子间存在氢键,使其具有卓越的机械性能
C.放电时,b极反应为$Li_{1-x}FePO_4+xe^-+xLi^+=LiFePO_4$
D.充电时,当生成1mol$Li_xC_6$时,有7g$Li^+$向左穿过CP-SSE
D
)
A.利用纤维素制备CP-SSE符合可持续发展要求
B.CP分子间存在氢键,使其具有卓越的机械性能
C.放电时,b极反应为$Li_{1-x}FePO_4+xe^-+xLi^+=LiFePO_4$
D.充电时,当生成1mol$Li_xC_6$时,有7g$Li^+$向左穿过CP-SSE
答案:
11.[答案] D
[分析] 该电池为二次电池,由工作原理可知,放电时,a 为负极,发生电极反应:$Li_xC_6 - xe^- \longrightarrow xLi^+ + C_6$,b 为正极,发生电极反应:$Li_{1 - x}FePO_4 + xe^- + xLi^+ \longrightarrow LiFePO_4$,装置中 CP 为电解质的固态载体。
[解析] A.纤维素属于可再生资源,利用纤维素制备 CP-SSE 符合可持续发展要求,A 项正确;B.CP 中存在羟基和氧原子,存在分子间氢键,增强了机械性能,B 项正确;C.由分析可知,放电时,b 极的电极反应为 $Li_{1 - x}FePO_4 + xe^- + xLi^+ \longrightarrow LiFePO_4$,C 项正确;D.充电时,a 极发生反应:$xLi^+ + C_6 + xe^- \longrightarrow Li_xC_6$,当生成 $1 mol Li_xC_6$ 时,消耗 $x mol Li^+$,即有 $7x g Li^+$ 向左穿过 CP-SSE,D 项错误;答案选 D。
[分析] 该电池为二次电池,由工作原理可知,放电时,a 为负极,发生电极反应:$Li_xC_6 - xe^- \longrightarrow xLi^+ + C_6$,b 为正极,发生电极反应:$Li_{1 - x}FePO_4 + xe^- + xLi^+ \longrightarrow LiFePO_4$,装置中 CP 为电解质的固态载体。
[解析] A.纤维素属于可再生资源,利用纤维素制备 CP-SSE 符合可持续发展要求,A 项正确;B.CP 中存在羟基和氧原子,存在分子间氢键,增强了机械性能,B 项正确;C.由分析可知,放电时,b 极的电极反应为 $Li_{1 - x}FePO_4 + xe^- + xLi^+ \longrightarrow LiFePO_4$,C 项正确;D.充电时,a 极发生反应:$xLi^+ + C_6 + xe^- \longrightarrow Li_xC_6$,当生成 $1 mol Li_xC_6$ 时,消耗 $x mol Li^+$,即有 $7x g Li^+$ 向左穿过 CP-SSE,D 项错误;答案选 D。
查看更多完整答案,请扫码查看


