2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第47页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
17.(15分)(2025·湖南·三模)近年来,新兴科技产业对钒产品纯度要求越来越高,VOCl₃是由工业级V₂O₅制取高纯V₂O₅的重要中间体。回答下列问题:
(1)工业上制备VOCl₃有以下两种方法,反应的热化学方程式和平衡常数如下:
方法Ⅰ. CCl₄氯化法:2V₂O₅(s) + 3CCl₄(g) 4VOCl₃(g) + 3CO₂(g) ΔH₁ < 0 K₁
方法Ⅱ. Cl₂配碳氯化法:2V₂O₅(s) + 3C(s) + 6Cl₂(g) 4VOCl₃(g) + 3CO₂(g) ΔH₂ < 0 K₂
反应C(s) + 2Cl₂(g) CCl₄(g)的ΔH = (填含ΔH₁、ΔH₂的式子);方法Ⅰ在500℃才能获得较高的反应速率,而方法Ⅱ在205℃即可得到相同的反应速率,则活化能Eₐ(方法Ⅰ)(填“>”“<”或“=”)Eₐ(方法Ⅱ)。
(2)在一定温度下向某恒容密闭容器中加入3mol V₂O₅(s)、3mol CCl₄(g),进行反应2V₂O₅(s) + 3CCl₄(g) 4VOCl₃(g) + 3CO₂(g),起始时压强为p₀ kPa,20min后达到平衡,测得V₂O₅(s)的转化率为40%。则0~20min内,CCl₄的反应速率v(CCl₄) = (用含p₀的式子表示)kPa·min⁻¹,VOCl₃(g)的平衡产率为%,Kₚ = (填含p₀的计算式,Kₚ用气体平衡分压代替平衡物质的量浓度进行计算)kPa⁴。
(3)在一定条件下,向恒容密闭容器中分别加入2mol V₂O₅(s)、4mol C(s)和8mol Cl₂(g),仅发生方法Ⅱ的反应,反应进行15min时测得V₂O₅(s)的转化率随温度和压强的变化如图所示。
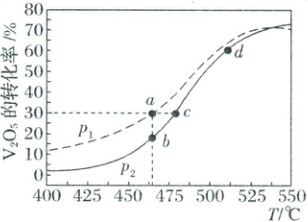
①p₁________(填“<”“>”或“=”)p₂;a、b、c三点对应的平衡常数Kₐ、Kb、Kc的大小关系为________。
②V₂O₅(s)的氯化在实际生产中控制反应温度为525℃并向恒压体系中充入N₂,试分析原因:________。
(1)工业上制备VOCl₃有以下两种方法,反应的热化学方程式和平衡常数如下:
方法Ⅰ. CCl₄氯化法:2V₂O₅(s) + 3CCl₄(g) 4VOCl₃(g) + 3CO₂(g) ΔH₁ < 0 K₁
方法Ⅱ. Cl₂配碳氯化法:2V₂O₅(s) + 3C(s) + 6Cl₂(g) 4VOCl₃(g) + 3CO₂(g) ΔH₂ < 0 K₂
反应C(s) + 2Cl₂(g) CCl₄(g)的ΔH = (填含ΔH₁、ΔH₂的式子);方法Ⅰ在500℃才能获得较高的反应速率,而方法Ⅱ在205℃即可得到相同的反应速率,则活化能Eₐ(方法Ⅰ)(填“>”“<”或“=”)Eₐ(方法Ⅱ)。
(2)在一定温度下向某恒容密闭容器中加入3mol V₂O₅(s)、3mol CCl₄(g),进行反应2V₂O₅(s) + 3CCl₄(g) 4VOCl₃(g) + 3CO₂(g),起始时压强为p₀ kPa,20min后达到平衡,测得V₂O₅(s)的转化率为40%。则0~20min内,CCl₄的反应速率v(CCl₄) = (用含p₀的式子表示)kPa·min⁻¹,VOCl₃(g)的平衡产率为%,Kₚ = (填含p₀的计算式,Kₚ用气体平衡分压代替平衡物质的量浓度进行计算)kPa⁴。
(3)在一定条件下,向恒容密闭容器中分别加入2mol V₂O₅(s)、4mol C(s)和8mol Cl₂(g),仅发生方法Ⅱ的反应,反应进行15min时测得V₂O₅(s)的转化率随温度和压强的变化如图所示。

①p₁________(填“<”“>”或“=”)p₂;a、b、c三点对应的平衡常数Kₐ、Kb、Kc的大小关系为________。
②V₂O₅(s)的氯化在实际生产中控制反应温度为525℃并向恒压体系中充入N₂,试分析原因:________。
答案:
17.[答案]
(1)$\frac{1}{3}$(ΔH₂−ΔH₁) >
(2)0.03p₀ 60 $\frac{(0.6p₀)^2×(0.8p₀)}{(0.4p₀)^3}$(或其他合理答案)
(3)①> Kₐ=Kb>Kc;温度过低,反应速率较慢,经济效益低;温度过高,生产能耗大,成本提高;恒压时向体系中充入N₂,相当于减小压强,有利于正向反应的进行,增大V₂O₅(s)的转化率
[解析]
(1)根据盖斯定律可知,目标反应等于$\frac{1}{3}$(方法Ⅰ-方法Ⅱ),则ΔH=$\frac{1}{3}$(ΔH₂−ΔH₁);方法Ⅰ在500℃才能获得较高的反应速率,而方法Ⅱ在205℃即可得到相同的反应速率,活化能越大,反应进行时所需温度越高,故活化能E_a(方法Ⅰ)>E_a(方法Ⅱ)。
(2)由题可知,在恒容密闭容器中,起始压强为p₀kPa,起始加入3molV₂O₅(s)、3molCCl₄(g),列三段式:
2V₂O₅(s)+3CCl₄(g)⇌4VOCl₃(g)+3CO₂(g)
初始量/mol 3 3 0 0
转化量/mol 3×40%=1.2 1.8 2.4 1.8
平衡量/mol 1.8 1.2 2.4 1.8
平衡时,气体总物质的量n=n(CCl₄)+n(VOCl₃)+n(CO₂)=1.2+2.4+1.8=5.4(mol),气体总压强为$\frac{5.4}{3}$×p₀kPa=1.8p₀kPa,CCl₄、VOCl₃、CO₂的分压依次为$\frac{1.2}{5.4}$×1.8p₀kPa=0.4p₀kPa、$\frac{2.4}{5.4}$×1.8p₀kPa=0.8p₀kPa、$\frac{1.8}{5.4}$×1.8p₀kPa=0.6p₀kPa。
初始投入的气体只有CCl₄(g),故p(CCl₄)初=p₀kPa,0~20min内,CCl₄的反应速率v(CCl₄)=$\frac{p₀kPa - 0.4p₀kPa}{20min}$=0.03p₀kPa·min⁻¹,VOCl₃的平衡产率=$\frac{实际产量}{理论产量}$×100%=$\frac{2.4mol}{4mol}$×100%=60%,K_p=$\frac{(0.6p₀)^2×(0.8p₀)}{(0.4p₀)^3}$kPa⁴。
(3)①由题可知,此反应为放热反应,温度升高,平衡会逆向移动,V₂O₅(s)的平衡转化率降低,但反应进行15min时测得V₂O₅(s)的转化率随温度升高而增大,故关系图中V₂O₅(s)的转化率并不是V₂O₅(s)的平衡转化率,当反应未达平衡时,压强越小,反应速率越慢,V₂O₅(s)的转化率越小,故压强p₁>p₂;平衡常数只和温度有关,a、b温度相同,K_a=K_b,c点温度高,温度升高,平衡会逆向移动,平衡常数减小,故K_a=K_b>K_c。
②V₂O₅(s)氯化过程中,由图可知,实际生产中若温度过低,反应速率较慢,经济效益低;若温度过高,生产能耗大,成本提高;恒压时向体系中充入N₂,相当于减小反应体系的压强,有利于正向反应的进行,增大V₂O₅(s)的转化率。
(1)$\frac{1}{3}$(ΔH₂−ΔH₁) >
(2)0.03p₀ 60 $\frac{(0.6p₀)^2×(0.8p₀)}{(0.4p₀)^3}$(或其他合理答案)
(3)①> Kₐ=Kb>Kc;温度过低,反应速率较慢,经济效益低;温度过高,生产能耗大,成本提高;恒压时向体系中充入N₂,相当于减小压强,有利于正向反应的进行,增大V₂O₅(s)的转化率
[解析]
(1)根据盖斯定律可知,目标反应等于$\frac{1}{3}$(方法Ⅰ-方法Ⅱ),则ΔH=$\frac{1}{3}$(ΔH₂−ΔH₁);方法Ⅰ在500℃才能获得较高的反应速率,而方法Ⅱ在205℃即可得到相同的反应速率,活化能越大,反应进行时所需温度越高,故活化能E_a(方法Ⅰ)>E_a(方法Ⅱ)。
(2)由题可知,在恒容密闭容器中,起始压强为p₀kPa,起始加入3molV₂O₅(s)、3molCCl₄(g),列三段式:
2V₂O₅(s)+3CCl₄(g)⇌4VOCl₃(g)+3CO₂(g)
初始量/mol 3 3 0 0
转化量/mol 3×40%=1.2 1.8 2.4 1.8
平衡量/mol 1.8 1.2 2.4 1.8
平衡时,气体总物质的量n=n(CCl₄)+n(VOCl₃)+n(CO₂)=1.2+2.4+1.8=5.4(mol),气体总压强为$\frac{5.4}{3}$×p₀kPa=1.8p₀kPa,CCl₄、VOCl₃、CO₂的分压依次为$\frac{1.2}{5.4}$×1.8p₀kPa=0.4p₀kPa、$\frac{2.4}{5.4}$×1.8p₀kPa=0.8p₀kPa、$\frac{1.8}{5.4}$×1.8p₀kPa=0.6p₀kPa。
初始投入的气体只有CCl₄(g),故p(CCl₄)初=p₀kPa,0~20min内,CCl₄的反应速率v(CCl₄)=$\frac{p₀kPa - 0.4p₀kPa}{20min}$=0.03p₀kPa·min⁻¹,VOCl₃的平衡产率=$\frac{实际产量}{理论产量}$×100%=$\frac{2.4mol}{4mol}$×100%=60%,K_p=$\frac{(0.6p₀)^2×(0.8p₀)}{(0.4p₀)^3}$kPa⁴。
(3)①由题可知,此反应为放热反应,温度升高,平衡会逆向移动,V₂O₅(s)的平衡转化率降低,但反应进行15min时测得V₂O₅(s)的转化率随温度升高而增大,故关系图中V₂O₅(s)的转化率并不是V₂O₅(s)的平衡转化率,当反应未达平衡时,压强越小,反应速率越慢,V₂O₅(s)的转化率越小,故压强p₁>p₂;平衡常数只和温度有关,a、b温度相同,K_a=K_b,c点温度高,温度升高,平衡会逆向移动,平衡常数减小,故K_a=K_b>K_c。
②V₂O₅(s)氯化过程中,由图可知,实际生产中若温度过低,反应速率较慢,经济效益低;若温度过高,生产能耗大,成本提高;恒压时向体系中充入N₂,相当于减小反应体系的压强,有利于正向反应的进行,增大V₂O₅(s)的转化率。
18.(15分)(2025·上海·三模)氯喹是一种用于治疗疟疾的药物,制药厂通常将其转化为磷酸氯喹,其合成路线如下图所示。

已知:

①
②
③RX + R + HX(R为烃基,X为卤原子)
(1)A→B中试剂a为。
(2)C→D的反应类型是反应。
(3)K中含氧官能团的名称是;K中有个手性碳原子。
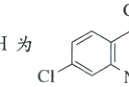
(4)H的结构简式为。
(5)E→F的化学方程式为________。
(6)下列有关氯喹和磷酸氯喹的说法正确的是。
A. 氯喹中所有C原子的杂化类型包括sp与sp²
B. 氯喹与NaOH乙醇溶液共热,可以发生消去反应
C. 将氯喹转化为磷酸氯喹的目的是增大溶解度,增强疗效
D. H₃PO₄可以电离产生PO₄³⁻,PO₄³⁻的空间构型为正四面体形
(7)已知:在有机化学中,苯环上原有的基团会对后引入基团有定位效应。如下表所示:

A→C反应顺序可否调换,并解释原因:________。
(8)写出一种符合下列条件的I的同分异构体(不含立体异构)的结构简式。
①能与饱和碳酸氢钠溶液反应放出CO₂
②能发生银镜反应
③核磁共振氢谱有四组峰
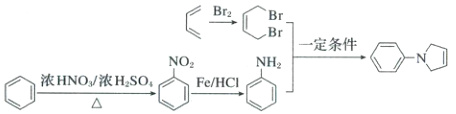
(9)参照上述合成路线,设计一条以1,3-丁二烯和苯为起始原料制备 的合成路线(无机试剂任选)。(合成路线可表示为:M N… 目标产物)


已知:

①
②
③RX + R + HX(R为烃基,X为卤原子)
(1)A→B中试剂a为。
(2)C→D的反应类型是反应。
(3)K中含氧官能团的名称是;K中有个手性碳原子。
(4)H的结构简式为。
(5)E→F的化学方程式为________。
(6)下列有关氯喹和磷酸氯喹的说法正确的是。
A. 氯喹中所有C原子的杂化类型包括sp与sp²
B. 氯喹与NaOH乙醇溶液共热,可以发生消去反应
C. 将氯喹转化为磷酸氯喹的目的是增大溶解度,增强疗效
D. H₃PO₄可以电离产生PO₄³⁻,PO₄³⁻的空间构型为正四面体形
(7)已知:在有机化学中,苯环上原有的基团会对后引入基团有定位效应。如下表所示:

A→C反应顺序可否调换,并解释原因:________。
(8)写出一种符合下列条件的I的同分异构体(不含立体异构)的结构简式。
①能与饱和碳酸氢钠溶液反应放出CO₂
②能发生银镜反应
③核磁共振氢谱有四组峰
(9)参照上述合成路线,设计一条以1,3-丁二烯和苯为起始原料制备 的合成路线(无机试剂任选)。(合成路线可表示为:M N… 目标产物)

答案:
18.[答案]
(1)浓硝酸与浓硫酸
(2)还原
(3)酮羰基和酯基 1
(4)
(5) COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$
COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$ +CH₃OH +H₂O
+CH₃OH +H₂O
(6)CD
(7)不能,若先氯化,使苯环邻、对位的氢更活泼,再硝化,硝基会取代在氯原子的邻位和对位,间位产物产率降低
(8)OHC−CH₂−$\stackrel{CH_3}{C}$−COOH或HOOC−CH₂−$\stackrel{CH_3}{C}$−CHO
(9)
[分析] 由后面的结构与A的分子式,确定A为苯,根据B的分子式确定B为硝基苯,B发生取代反应为C,结合C→D是将硝基转化为氨基,反应类型是还原反应。
[解析]
(1)在苯上引入硝基,需要条件为浓硫酸、浓硝酸、加热。
(2)C→D是将硝基转化为氨基,反应类型是还原反应。
(3)观察知,K中含氧官能团的名称是酮羰基和酯基,其中手性碳原子(连有4个各不相同的原子或基团的碳原子)有1个。
(4)由分析得H为 。
。
(5)E→F的化学方程式为 COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$
COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$ +CH₃OH +H₂O。
+CH₃OH +H₂O。
(6)A.氯喹中C原子有全为单键的也有含有双键的碳原子,其杂化类型包括sp³与sp²,A错误。
B.氯喹结构中氯原子在苯环上与NaOH乙醇溶液共热,不能发生消去反应,B错误。
C.磷酸氯喹可与水形成氢键,将氯喹转化为磷酸氯喹的目的是增大溶解度,增强疗效,C正确。
D.PO₄³⁻的价层电子对为4+$\frac{5 + 3 - 2×4}{2}$=4,PO₄³⁻空间构型为正四面体形,D正确。
故选CD。
(7)不能;若先氯化,使苯环邻、对位的氢更活泼,再硝化,硝基会取代在氯原子的邻位和对位,间位产物产率降低。
(8)I的同分异构体能与饱和碳酸氢钠溶液反应放出CO₂,说明结构中有—COOH,能发生银镜反应,结构中含有—CHO,则核磁共振氢谱有四组峰(含4种氢原子)的结构简式为OHC−CH₂−$\stackrel{CH_3}{C}$−COOH或HOOC−CH₂−$\stackrel{CH_3}{C}$−CHO。
(9)根据题中信息结合所学知识,先用1,3−丁二烯和溴水发生1,4加成产生 ,苯在浓硝酸、浓硫酸加热生成硝基苯,硝基苯再被还原为苯胺,苯胺和
,苯在浓硝酸、浓硫酸加热生成硝基苯,硝基苯再被还原为苯胺,苯胺和 根据该RX+—NH—$\stackrel{一定条件}{\longrightarrow}$R—N+HX反应原理,即可得目标产物,合成路线如下:
根据该RX+—NH—$\stackrel{一定条件}{\longrightarrow}$R—N+HX反应原理,即可得目标产物,合成路线如下: 。
。
18.[答案]
(1)浓硝酸与浓硫酸
(2)还原
(3)酮羰基和酯基 1
(4)

(5)
 COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$
COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$ +CH₃OH +H₂O
+CH₃OH +H₂O(6)CD
(7)不能,若先氯化,使苯环邻、对位的氢更活泼,再硝化,硝基会取代在氯原子的邻位和对位,间位产物产率降低
(8)OHC−CH₂−$\stackrel{CH_3}{C}$−COOH或HOOC−CH₂−$\stackrel{CH_3}{C}$−CHO
(9)

[分析] 由后面的结构与A的分子式,确定A为苯,根据B的分子式确定B为硝基苯,B发生取代反应为C,结合C→D是将硝基转化为氨基,反应类型是还原反应。
[解析]
(1)在苯上引入硝基,需要条件为浓硫酸、浓硝酸、加热。
(2)C→D是将硝基转化为氨基,反应类型是还原反应。
(3)观察知,K中含氧官能团的名称是酮羰基和酯基,其中手性碳原子(连有4个各不相同的原子或基团的碳原子)有1个。
(4)由分析得H为
 。
。(5)E→F的化学方程式为
 COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$
COOCH₃ +2NaOH$\stackrel{H_2O}{\triangle}$ +CH₃OH +H₂O。
+CH₃OH +H₂O。(6)A.氯喹中C原子有全为单键的也有含有双键的碳原子,其杂化类型包括sp³与sp²,A错误。
B.氯喹结构中氯原子在苯环上与NaOH乙醇溶液共热,不能发生消去反应,B错误。
C.磷酸氯喹可与水形成氢键,将氯喹转化为磷酸氯喹的目的是增大溶解度,增强疗效,C正确。
D.PO₄³⁻的价层电子对为4+$\frac{5 + 3 - 2×4}{2}$=4,PO₄³⁻空间构型为正四面体形,D正确。
故选CD。
(7)不能;若先氯化,使苯环邻、对位的氢更活泼,再硝化,硝基会取代在氯原子的邻位和对位,间位产物产率降低。
(8)I的同分异构体能与饱和碳酸氢钠溶液反应放出CO₂,说明结构中有—COOH,能发生银镜反应,结构中含有—CHO,则核磁共振氢谱有四组峰(含4种氢原子)的结构简式为OHC−CH₂−$\stackrel{CH_3}{C}$−COOH或HOOC−CH₂−$\stackrel{CH_3}{C}$−CHO。
(9)根据题中信息结合所学知识,先用1,3−丁二烯和溴水发生1,4加成产生
 ,苯在浓硝酸、浓硫酸加热生成硝基苯,硝基苯再被还原为苯胺,苯胺和
,苯在浓硝酸、浓硫酸加热生成硝基苯,硝基苯再被还原为苯胺,苯胺和 根据该RX+—NH—$\stackrel{一定条件}{\longrightarrow}$R—N+HX反应原理,即可得目标产物,合成路线如下:
根据该RX+—NH—$\stackrel{一定条件}{\longrightarrow}$R—N+HX反应原理,即可得目标产物,合成路线如下: 。
。 查看更多完整答案,请扫码查看


