2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第21页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
20.小分子在科学研究和生产实践中有着重要作用。CO2和NH3均为小分子,具有广泛用途。请回答下
列问题:
Ⅰ.CO2在化工合成中的应用。
i.甲醇的制备:利用CO2和H2合成甲醇,主要涉及以下反应。
反应①:CO2(g)+3H2(g)CHOH(g)+H2O(g) △H1=−49kJ.mol−1;
反应②:CO2(g)+H2CO(g)+H2O(g) △H2=+41kJ.mol−1。
在1L的密闭容器中,加入催化剂,并投入1molCO2和3molH2发生上述两个反应,平衡时,CO2的
转化率和甲醇的选择性随温度的变化趋势如图1所示。
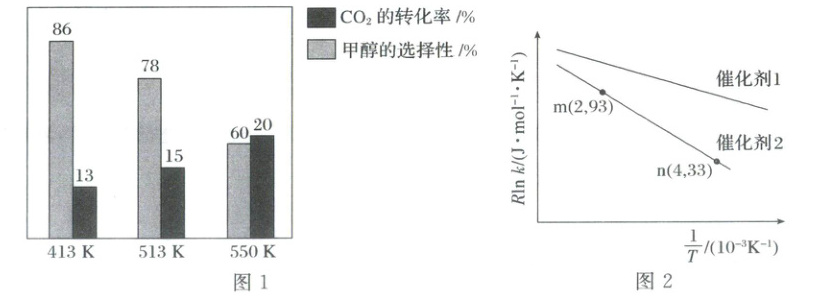
(1)由图1可知,制备甲醇最适宜的温度为________(填“413K”“513K”或“550K”)。
(2)550K下,达到平衡时,若该反应体系的总压强为p,则反应①的K,=________(列出计算式即可)。
ii.甲酸(HCOOH)的制备:工业上制备甲酸的原理为CO2(g)+H2(g)一一HCOOH(g),,该反应的速
率方程为u=k.c(CO2).c(H2)。
(3)已知Arrhenius经验公式为Rlnk=−$\frac{Ea}{T}$+C(Ea为活化能,k为速率常数,R和C均为常数)。在催
化剂1和催化剂2作用下,测得反应CO2(g)+H2(g)HCOOH(g)的Rllnk与$\frac{1}{T}$的关系如图2所
示。其中催化效率比较高的是________(填“催化剂1”或“催化剂2”),在催化剂2的作用下,活化能Ea
=__________kJ.mol−1。
Ⅱ.NH3在生活、科研等方面的应用。
i.利用NH3消除NO污染:NO是主要大气污染物,利用NH3消除NO的原理为4NH3(g)+
6NO(g)1 5N2(g)+6H2O(g) △H<0。
(4)①该反应在________(填“高温”“低温”或“任意条件”)下能自发进行。
②向某恒容绝热的密闭容器中加入等物质的量的NH3(g)和NO(g)发生上述反应,下列叙述能说明反
应已经达到平衡状态的是________(填标号)。
A.U(NO)=v(H2O)
B.相同时间内断裂N−H键、H−O键的数目相同
C.化学平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
iv.NH3在配合物领域中的应用:溶液中NH3能与多种金属阳离子形成配合物,配合物稳定常数K
可以用来描述配体与配离子之间相互作用的强度,其定义如下(M代表中心金属原子或金属离子,L代
表配体,n代表配体数量):M+nLMLn K(MLn)=$\frac{c(MLn)}{c(M).c”(L)}$。
(5)已知:常温下,Ksp(AgC1)=1.8×10−10,K{[Ag(NH3)2]+}=2.5×107,忽略NH.H2O的电离,若
使0.05molAgC1完全溶解于1L氨水中,则氨水的浓度c(NH.H2O)至少为________mol.L−1(列出
计算式即可)。
列问题:
Ⅰ.CO2在化工合成中的应用。
i.甲醇的制备:利用CO2和H2合成甲醇,主要涉及以下反应。
反应①:CO2(g)+3H2(g)CHOH(g)+H2O(g) △H1=−49kJ.mol−1;
反应②:CO2(g)+H2CO(g)+H2O(g) △H2=+41kJ.mol−1。
在1L的密闭容器中,加入催化剂,并投入1molCO2和3molH2发生上述两个反应,平衡时,CO2的
转化率和甲醇的选择性随温度的变化趋势如图1所示。

(1)由图1可知,制备甲醇最适宜的温度为________(填“413K”“513K”或“550K”)。
(2)550K下,达到平衡时,若该反应体系的总压强为p,则反应①的K,=________(列出计算式即可)。
ii.甲酸(HCOOH)的制备:工业上制备甲酸的原理为CO2(g)+H2(g)一一HCOOH(g),,该反应的速
率方程为u=k.c(CO2).c(H2)。
(3)已知Arrhenius经验公式为Rlnk=−$\frac{Ea}{T}$+C(Ea为活化能,k为速率常数,R和C均为常数)。在催
化剂1和催化剂2作用下,测得反应CO2(g)+H2(g)HCOOH(g)的Rllnk与$\frac{1}{T}$的关系如图2所
示。其中催化效率比较高的是________(填“催化剂1”或“催化剂2”),在催化剂2的作用下,活化能Ea
=__________kJ.mol−1。
Ⅱ.NH3在生活、科研等方面的应用。
i.利用NH3消除NO污染:NO是主要大气污染物,利用NH3消除NO的原理为4NH3(g)+
6NO(g)1 5N2(g)+6H2O(g) △H<0。
(4)①该反应在________(填“高温”“低温”或“任意条件”)下能自发进行。
②向某恒容绝热的密闭容器中加入等物质的量的NH3(g)和NO(g)发生上述反应,下列叙述能说明反
应已经达到平衡状态的是________(填标号)。
A.U(NO)=v(H2O)
B.相同时间内断裂N−H键、H−O键的数目相同
C.化学平衡常数不再变化
D.混合气体的平均相对分子质量不再变化
iv.NH3在配合物领域中的应用:溶液中NH3能与多种金属阳离子形成配合物,配合物稳定常数K
可以用来描述配体与配离子之间相互作用的强度,其定义如下(M代表中心金属原子或金属离子,L代
表配体,n代表配体数量):M+nLMLn K(MLn)=$\frac{c(MLn)}{c(M).c”(L)}$。
(5)已知:常温下,Ksp(AgC1)=1.8×10−10,K{[Ag(NH3)2]+}=2.5×107,忽略NH.H2O的电离,若
使0.05molAgC1完全溶解于1L氨水中,则氨水的浓度c(NH.H2O)至少为________mol.L−1(列出
计算式即可)。
答案:
$20.(1)513K (2)\frac{0.8y + 0.2x}{x + y} (3)$催化剂1 30
(4)①任意条件$ ②BCD (5)\frac{\sqrt{5}}{3} + 0.1$
(4)①任意条件$ ②BCD (5)\frac{\sqrt{5}}{3} + 0.1$
查看更多完整答案,请扫码查看


