2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
12. (2025·湖北武汉·模拟预测)一种钾离子电池正极材料钾锰铁基普鲁士白[K₂MnFe(CN)₆]充电或放电时变化如下图所示,其中Ⅰ、Ⅱ、Ⅲ为晶胞俯视图。下列说法中错误的是(

A.Ⅰ晶胞中K⁺数目为8
B.Ⅱ→Ⅲ过程中Fe或Mn的价态升高
C.每个晶胞Ⅰ完全转化为晶胞Ⅱ,转移电子数为4
D.晶胞Ⅲ中π键数目为24
D
)
A.Ⅰ晶胞中K⁺数目为8
B.Ⅱ→Ⅲ过程中Fe或Mn的价态升高
C.每个晶胞Ⅰ完全转化为晶胞Ⅱ,转移电子数为4
D.晶胞Ⅲ中π键数目为24
答案:
12.[答案] D
[分析] 钾锰铁基普鲁士白[K₂MnFe(CN)₆]是一种钾离子电池正极材料,充电时装置为电解池,其为阳极,失去电子发生氧化反应,充电随着K⁺脱出,其结构由Ⅰ经Ⅱ最终转变为Ⅲ,则Ⅲ转化为Ⅰ是原电池放电过程。
[解析] A.充电过程中K⁺脱出,Ⅱ晶胞中K⁺个数为4,ⅢK⁺全部脱出,由此可知,K⁺填充在整个晶胞的8个小立方体的体心,个数为8,A正确;B.Ⅱ→Ⅲ过程中为充电过程,阳极发生氧化反应,则Fe或Mn的价态升高,B正确;C.每个晶胞Ⅰ完全转化为晶胞Ⅱ,有4个K⁺脱出,转移电子数为4,C正确;D.晶胞Ⅲ中含12×$\frac{1}{4}$ + 1 = 4个FeC₆N₆、8×$\frac{1}{8}$ + 6×$\frac{1}{2}$ = 4个MnN₆,由钾锰铁基普鲁士白[K₂MnFe(CN)₆]的化学式可知,晶胞Ⅲ中含有24个CN⁻,π键数目为48,D错误;故选D。
[分析] 钾锰铁基普鲁士白[K₂MnFe(CN)₆]是一种钾离子电池正极材料,充电时装置为电解池,其为阳极,失去电子发生氧化反应,充电随着K⁺脱出,其结构由Ⅰ经Ⅱ最终转变为Ⅲ,则Ⅲ转化为Ⅰ是原电池放电过程。
[解析] A.充电过程中K⁺脱出,Ⅱ晶胞中K⁺个数为4,ⅢK⁺全部脱出,由此可知,K⁺填充在整个晶胞的8个小立方体的体心,个数为8,A正确;B.Ⅱ→Ⅲ过程中为充电过程,阳极发生氧化反应,则Fe或Mn的价态升高,B正确;C.每个晶胞Ⅰ完全转化为晶胞Ⅱ,有4个K⁺脱出,转移电子数为4,C正确;D.晶胞Ⅲ中含12×$\frac{1}{4}$ + 1 = 4个FeC₆N₆、8×$\frac{1}{8}$ + 6×$\frac{1}{2}$ = 4个MnN₆,由钾锰铁基普鲁士白[K₂MnFe(CN)₆]的化学式可知,晶胞Ⅲ中含有24个CN⁻,π键数目为48,D错误;故选D。
13. (2025·江苏·二模)室温下,H₂C₂O₄溶液中含碳微粒的分布系数与pH的关系如图所示。

已知C₂O₄²⁻的分布系数:
δ(C₂O₄²⁻) = $\frac{c(C₂O₄²⁻)}{c(H₂C₂O₄) + c(HC₂O₄⁻) + c(C₂O₄²⁻)}$
下列说法正确的是(
A.pH = 3.0时:c(HC₂O₄⁻) > c(H₂C₂O₄) > c(C₂O₄²⁻)
B.浓度均为0.1 mol·L⁻¹ Na₂C₂O₄和NaHC₂O₄的混合液中:c(HC₂O₄⁻) > c(C₂O₄²⁻)
C.向0.1 mol·L⁻¹ H₂C₂O₄溶液中滴加氨水至pH = 7的溶液中:c(NH₄⁺) + c(NH₃·H₂O) > c(H₂C₂O₄) + c(HC₂O₄⁻) + c(C₂O₄²⁻)
D.向0.1 mol·L⁻¹ H₂C₂O₄溶液中加入NaOH溶液至pH = 4.2的反应:3H₂C₂O₄ + 5OH⁻ = HC₂O₄⁻ + 2C₂O₄²⁻ + 5H₂O

已知C₂O₄²⁻的分布系数:
δ(C₂O₄²⁻) = $\frac{c(C₂O₄²⁻)}{c(H₂C₂O₄) + c(HC₂O₄⁻) + c(C₂O₄²⁻)}$
下列说法正确的是(
C
)A.pH = 3.0时:c(HC₂O₄⁻) > c(H₂C₂O₄) > c(C₂O₄²⁻)
B.浓度均为0.1 mol·L⁻¹ Na₂C₂O₄和NaHC₂O₄的混合液中:c(HC₂O₄⁻) > c(C₂O₄²⁻)
C.向0.1 mol·L⁻¹ H₂C₂O₄溶液中滴加氨水至pH = 7的溶液中:c(NH₄⁺) + c(NH₃·H₂O) > c(H₂C₂O₄) + c(HC₂O₄⁻) + c(C₂O₄²⁻)
D.向0.1 mol·L⁻¹ H₂C₂O₄溶液中加入NaOH溶液至pH = 4.2的反应:3H₂C₂O₄ + 5OH⁻ = HC₂O₄⁻ + 2C₂O₄²⁻ + 5H₂O
答案:
13.[答案] C
[分析] 草酸(H₂C₂O₄)是一种二元弱酸,存在电离平衡,H₂C₂O₄ ⇌ HCO₃⁻ + H⁺、HCO₃⁻ ⇌ C₂O₄²⁻ + H⁺,随着pH增大,c(H₂C₂O₄)减小,c(HCO₃⁻)先增大,后减小,c(C₂O₄²⁻)增大,故曲线Ⅰ表示δ(H₂C₂O₄)随pH变化,曲线Ⅱ表示δ(HCO₃⁻)随pH变化,曲线Ⅲ表示δ(C₂O₄²⁻)随pH变化,Kₐ₁ = c(H⁺)×c(HCO₃⁻)/c(H₂C₂O₄),由Ⅰ和Ⅱ交点可知,Kₐ₁ = c(H⁺)×c(HCO₃⁻)/c(H₂C₂O₄) = 10⁻¹.²,同理Kₐ₂ = c(H⁺)×c(C₂O₄²⁻)/c(HCO₃⁻) = 10⁻⁴.²。
[解析] A.pH = 3.0时,由曲线各微粒分布系数可知,Ⅱ > Ⅲ > Ⅰ,则离子浓度:c(HCO₃⁻) > c(C₂O₄²⁻) > c(H₂C₂O₄),A错误;B.由图知,浓度相等的Na₂C₂O₄和NaHCO₃混合溶液显酸性,HCO₃⁻电离程度大于C₂O₄²⁻水解程度,则溶液中:c(HCO₃⁻) < c(C₂O₄²⁻),B错误;C.由图可知,pH = 7时,含碳微粒主要以C₂O₄²⁻形式存在,故此时溶质主要是(NH₄)₂C₂O₄,则溶液中存在物料守恒:c(NH₄⁺) + c(NH₃·H₂O) = 2[c(H₂C₂O₄) + c(HCO₃⁻) + c(C₂O₄²⁻)],则:c(NH₄⁺) + c(NH₃·H₂O) > c(H₂C₂O₄) + c(HCO₃⁻) + c(C₂O₄²⁻),C正确;D.向0.1mol·L⁻¹H₂C₂O₄溶液中加入NaOH溶液至pH = 4.2时,得到等浓度的HCO₃⁻和C₂O₄²⁻,则离子方程式为2H₂C₂O₄ + 3OH⁻ = HCO₃⁻ + C₂O₄²⁻ + 3H₂O,D错误;故答案为C。
[分析] 草酸(H₂C₂O₄)是一种二元弱酸,存在电离平衡,H₂C₂O₄ ⇌ HCO₃⁻ + H⁺、HCO₃⁻ ⇌ C₂O₄²⁻ + H⁺,随着pH增大,c(H₂C₂O₄)减小,c(HCO₃⁻)先增大,后减小,c(C₂O₄²⁻)增大,故曲线Ⅰ表示δ(H₂C₂O₄)随pH变化,曲线Ⅱ表示δ(HCO₃⁻)随pH变化,曲线Ⅲ表示δ(C₂O₄²⁻)随pH变化,Kₐ₁ = c(H⁺)×c(HCO₃⁻)/c(H₂C₂O₄),由Ⅰ和Ⅱ交点可知,Kₐ₁ = c(H⁺)×c(HCO₃⁻)/c(H₂C₂O₄) = 10⁻¹.²,同理Kₐ₂ = c(H⁺)×c(C₂O₄²⁻)/c(HCO₃⁻) = 10⁻⁴.²。
[解析] A.pH = 3.0时,由曲线各微粒分布系数可知,Ⅱ > Ⅲ > Ⅰ,则离子浓度:c(HCO₃⁻) > c(C₂O₄²⁻) > c(H₂C₂O₄),A错误;B.由图知,浓度相等的Na₂C₂O₄和NaHCO₃混合溶液显酸性,HCO₃⁻电离程度大于C₂O₄²⁻水解程度,则溶液中:c(HCO₃⁻) < c(C₂O₄²⁻),B错误;C.由图可知,pH = 7时,含碳微粒主要以C₂O₄²⁻形式存在,故此时溶质主要是(NH₄)₂C₂O₄,则溶液中存在物料守恒:c(NH₄⁺) + c(NH₃·H₂O) = 2[c(H₂C₂O₄) + c(HCO₃⁻) + c(C₂O₄²⁻)],则:c(NH₄⁺) + c(NH₃·H₂O) > c(H₂C₂O₄) + c(HCO₃⁻) + c(C₂O₄²⁻),C正确;D.向0.1mol·L⁻¹H₂C₂O₄溶液中加入NaOH溶液至pH = 4.2时,得到等浓度的HCO₃⁻和C₂O₄²⁻,则离子方程式为2H₂C₂O₄ + 3OH⁻ = HCO₃⁻ + C₂O₄²⁻ + 3H₂O,D错误;故答案为C。
14. (2025·江苏苏州·三模)一种捕获并资源化利用CO₂的方法是将CO₂催化加氢合成CH₃OCH₃,其过程中主要发生如下反应:
Ⅰ. 2CO₂(g) + 6H₂(g) = CH₃OCH₃(g) + 3H₂O(g) ΔH₁ = -122.5 kJ·mol⁻¹
Ⅱ. CO₂(g) + H₂(g) = CO(g) + H₂O(g) ΔH₂ = +41.2 kJ·mol⁻¹
向恒压密闭容器中充入1 mol CO₂和3 mol H₂,CO₂的平衡转化率和CH₃OCH₃的平衡选择性[CH₃OCH₃的选择性 = $\frac{2n(CH₃OCH₃)}{n(反应的CO₂)}$ × 100%]随温度的变化如图所示。下列说法不正确的是(
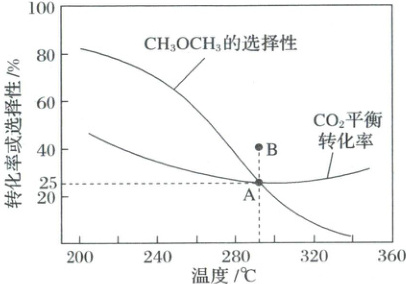
A.A点时,容器中n(CH₃OCH₃)为0.0625 mol
B.反应2CO(g) + 4H₂(g) = CH₃OCH₃(g) + H₂O(g)的ΔH = -204.9 kJ·mol⁻¹
C.CO₂平衡转化率由A到B点,可采取的措施为加压或减小$\frac{n(CO₂)}{n(H₂)}$
D.使用对反应Ⅰ催化活性更高的催化剂可提高CH₃OCH₃的实际选择性
Ⅰ. 2CO₂(g) + 6H₂(g) = CH₃OCH₃(g) + 3H₂O(g) ΔH₁ = -122.5 kJ·mol⁻¹
Ⅱ. CO₂(g) + H₂(g) = CO(g) + H₂O(g) ΔH₂ = +41.2 kJ·mol⁻¹
向恒压密闭容器中充入1 mol CO₂和3 mol H₂,CO₂的平衡转化率和CH₃OCH₃的平衡选择性[CH₃OCH₃的选择性 = $\frac{2n(CH₃OCH₃)}{n(反应的CO₂)}$ × 100%]随温度的变化如图所示。下列说法不正确的是(
C
)
A.A点时,容器中n(CH₃OCH₃)为0.0625 mol
B.反应2CO(g) + 4H₂(g) = CH₃OCH₃(g) + H₂O(g)的ΔH = -204.9 kJ·mol⁻¹
C.CO₂平衡转化率由A到B点,可采取的措施为加压或减小$\frac{n(CO₂)}{n(H₂)}$
D.使用对反应Ⅰ催化活性更高的催化剂可提高CH₃OCH₃的实际选择性
答案:
14.[答案] C
[解析] A.A点时,CO₂的平衡转化率为25%,反应的CO₂的物质的量为1mol×25% = 0.25mol,CH₃OCH₃的平衡选择性为50%,则2n(CH₃OCH₃)/0.25mol×100% = 50%,解得n(CH₃OCH₃) = 0.0625mol,A正确;B.根据盖斯定律,反应Ⅰ - 2×反应Ⅱ得:2CO(g) + 4H₂(g) = CH₃OCH₃(g) + H₂O(g),ΔH = ΔH₁ - 2ΔH₂ = -122.5kJ·mol⁻¹ - 2×41.2kJ·mol⁻¹ = -204.9kJ·mol⁻¹,B正确;C.由图可知,A到B点温度升高,CO₂平衡转化率增大,反应Ⅰ为放热反应,升高温度平衡逆向移动,反应Ⅱ为吸热反应,升高温度平衡正向移动,说明B点时反应Ⅱ为主,加压会使反应Ⅰ平衡正向移动,反应Ⅱ平衡不移动,CO₂平衡转化率不一定增大,减小n(CO₂)/n(H₂),即增大H₂的浓度,CO₂的平衡转化率增大,但温度也会影响平衡,无法确定,C错误;D.使用对反应Ⅰ催化活性更高的催化剂,可加快反应Ⅰ的速率,提高CH₃OCH₃的实际选择性,D正确;故选C。
[解析] A.A点时,CO₂的平衡转化率为25%,反应的CO₂的物质的量为1mol×25% = 0.25mol,CH₃OCH₃的平衡选择性为50%,则2n(CH₃OCH₃)/0.25mol×100% = 50%,解得n(CH₃OCH₃) = 0.0625mol,A正确;B.根据盖斯定律,反应Ⅰ - 2×反应Ⅱ得:2CO(g) + 4H₂(g) = CH₃OCH₃(g) + H₂O(g),ΔH = ΔH₁ - 2ΔH₂ = -122.5kJ·mol⁻¹ - 2×41.2kJ·mol⁻¹ = -204.9kJ·mol⁻¹,B正确;C.由图可知,A到B点温度升高,CO₂平衡转化率增大,反应Ⅰ为放热反应,升高温度平衡逆向移动,反应Ⅱ为吸热反应,升高温度平衡正向移动,说明B点时反应Ⅱ为主,加压会使反应Ⅰ平衡正向移动,反应Ⅱ平衡不移动,CO₂平衡转化率不一定增大,减小n(CO₂)/n(H₂),即增大H₂的浓度,CO₂的平衡转化率增大,但温度也会影响平衡,无法确定,C错误;D.使用对反应Ⅰ催化活性更高的催化剂,可加快反应Ⅰ的速率,提高CH₃OCH₃的实际选择性,D正确;故选C。
查看更多完整答案,请扫码查看


