2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
13.(2025·河南开封·三模)利用测压法在刚性反应器中研究30℃时N₂O₅(g)分解反应:
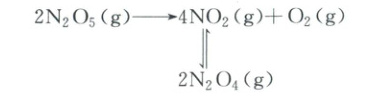
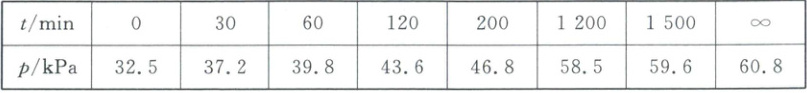
其中NO₂二聚为N₂O₄的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t = ∞时,N₂O₅(g)完全分解]:
下列说法正确的是(
A.0~30min内,v(N₂O₅) ≈ 1.6×10⁻³ kPa·min⁻¹
B.30℃时,反应N₂O₄(g) 2NO₂(g)的平衡常数Kₚ ≈ 10.2 kPa
C.若提高反应温度至40℃,则N₂O₅(g)完全分解后体系压强p∞(40℃) < 60.8 kPa
D.研究表明,N₂O₅(g)分解的反应速率v = 1.8×10⁻³ × p(N₂O₅)(kPa·min⁻¹),t = 50min时,测得体系中p(O₂) = 2.2 kPa,则此时v ≈ 0.0506 kPa·min⁻¹

其中NO₂二聚为N₂O₄的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t = ∞时,N₂O₅(g)完全分解]:

下列说法正确的是(
D
)A.0~30min内,v(N₂O₅) ≈ 1.6×10⁻³ kPa·min⁻¹
B.30℃时,反应N₂O₄(g) 2NO₂(g)的平衡常数Kₚ ≈ 10.2 kPa
C.若提高反应温度至40℃,则N₂O₅(g)完全分解后体系压强p∞(40℃) < 60.8 kPa
D.研究表明,N₂O₅(g)分解的反应速率v = 1.8×10⁻³ × p(N₂O₅)(kPa·min⁻¹),t = 50min时,测得体系中p(O₂) = 2.2 kPa,则此时v ≈ 0.0506 kPa·min⁻¹
答案:
13.[答案] D
[分析] N₂O₅(g)的分解不是可逆反应,t=∞时,N₂O₅(g)完全分解;2NO₂(g)⇌N₂O₄(g)为放热反应,因此当N₂O₅(g)完全分解后,产生的O₂的压强必为16.25kPa,30℃时,反应N₂O₅(g)⇌2NO₂(g)
起始(p/kPa) 32.5×2 0
转化(p/kPa) y $\frac{y}{2}$
平衡(p/kPa) 65−y $\frac{y}{2}$
65−y+$\frac{y}{2}$+16.25=60.8,y=40.9kPa,K_p=$\frac{p(N_2O_4)}{p(NO_2)^2}$=$\frac{20.45kPa}{(24.1kPa)^2}$=$\frac{1}{28.4}kPa$,据此分析。
[解析] A.0~30min内,设N₂O₅(g)分解了xkPa,则生成的NO₂压强为2xkPa,则生成的O₂压强为$\frac{x}{2}$kPa,设有wkPa的NO₂发生了转化,列三段式:
2NO₂(g)⇌N₂O₄(g)
起始(p/kPa) 2x 0
转化(p/kPa) w $\frac{w}{2}$
平衡(p/kPa) 2x−w $\frac{w}{2}$
2x−w+$\frac{w}{2}$+$\frac{x}{2}$=37.2kPa,因NO₂二聚为N₂O₄的反应可以迅速达到平衡,即达到平衡状态,故K_p=$\frac{p(N_2O_4)}{p(NO_2)^2}$=$\frac{\frac{w}{2}}{(2x - w)^2}$=$\frac{1}{28.4}kPa$,解得w=21.65kPa,x=19.21kPa,v(N₂O₅)=$\frac{\Delta p}{\Delta t}$=$\frac{19.21kPa}{30min}$≈0.64kPa·min⁻¹,A错误。
B.根据分析可知,30℃时,反应N₂O₄(g)⇌2NO₂(g)平衡常数K=$\frac{p(NO_2)^2}{p(N_2O_4)}$=$\frac{(24.1kPa)^2}{20.45kPa}$=28.4kPa,B错误。
C.2NO₂(g)⇌N₂O₄(g)为放热反应,升温,平衡逆向移动,压强会增大,C错误。
D.研究表明,N₂O₅(g)分解的反应速率v=1.8×10⁻³×p(N₂O₅)(kPa·min⁻¹),t=50min时,测得体系中p(O₂)=2.2kPa,则此时p(N₂O₅)=32.5kPa −2×2.2kPa=28.1kPa,则v=1.8×10⁻³×p(N₂O₅)(kPa·min⁻¹)≈0.0506kPa·min⁻¹,D 正确。
故选D。
[分析] N₂O₅(g)的分解不是可逆反应,t=∞时,N₂O₅(g)完全分解;2NO₂(g)⇌N₂O₄(g)为放热反应,因此当N₂O₅(g)完全分解后,产生的O₂的压强必为16.25kPa,30℃时,反应N₂O₅(g)⇌2NO₂(g)
起始(p/kPa) 32.5×2 0
转化(p/kPa) y $\frac{y}{2}$
平衡(p/kPa) 65−y $\frac{y}{2}$
65−y+$\frac{y}{2}$+16.25=60.8,y=40.9kPa,K_p=$\frac{p(N_2O_4)}{p(NO_2)^2}$=$\frac{20.45kPa}{(24.1kPa)^2}$=$\frac{1}{28.4}kPa$,据此分析。
[解析] A.0~30min内,设N₂O₅(g)分解了xkPa,则生成的NO₂压强为2xkPa,则生成的O₂压强为$\frac{x}{2}$kPa,设有wkPa的NO₂发生了转化,列三段式:
2NO₂(g)⇌N₂O₄(g)
起始(p/kPa) 2x 0
转化(p/kPa) w $\frac{w}{2}$
平衡(p/kPa) 2x−w $\frac{w}{2}$
2x−w+$\frac{w}{2}$+$\frac{x}{2}$=37.2kPa,因NO₂二聚为N₂O₄的反应可以迅速达到平衡,即达到平衡状态,故K_p=$\frac{p(N_2O_4)}{p(NO_2)^2}$=$\frac{\frac{w}{2}}{(2x - w)^2}$=$\frac{1}{28.4}kPa$,解得w=21.65kPa,x=19.21kPa,v(N₂O₅)=$\frac{\Delta p}{\Delta t}$=$\frac{19.21kPa}{30min}$≈0.64kPa·min⁻¹,A错误。
B.根据分析可知,30℃时,反应N₂O₄(g)⇌2NO₂(g)平衡常数K=$\frac{p(NO_2)^2}{p(N_2O_4)}$=$\frac{(24.1kPa)^2}{20.45kPa}$=28.4kPa,B错误。
C.2NO₂(g)⇌N₂O₄(g)为放热反应,升温,平衡逆向移动,压强会增大,C错误。
D.研究表明,N₂O₅(g)分解的反应速率v=1.8×10⁻³×p(N₂O₅)(kPa·min⁻¹),t=50min时,测得体系中p(O₂)=2.2kPa,则此时p(N₂O₅)=32.5kPa −2×2.2kPa=28.1kPa,则v=1.8×10⁻³×p(N₂O₅)(kPa·min⁻¹)≈0.0506kPa·min⁻¹,D 正确。
故选D。
14.(2025·天津河西·二模)亚磷酸(H₃PO₃)为二元弱酸,分子结构是 。25℃时,某亚磷酸溶液中含磷微粒的浓度之和为0.1mol/L,溶液中所有含磷微粒的pc与pOH的关系如图所示。
。25℃时,某亚磷酸溶液中含磷微粒的浓度之和为0.1mol/L,溶液中所有含磷微粒的pc与pOH的关系如图所示。
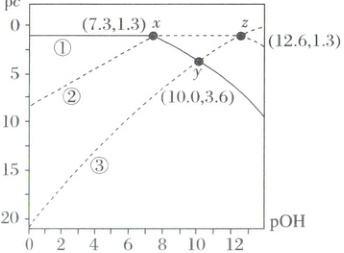
已知:pc = -lg c,pOH = -lg c(OH⁻),下列说法正确的是(
A.亚磷酸溶液中:c(H⁺) = c(H₂PO₃⁻) + 2c(HPO₃²⁻) + 3c(PO₃³⁻) + c(OH⁻)
B.水的电离程度:x < y < z
C.溶液pH = 4时:c(H₂PO₃⁻) + 2c(HPO₃²⁻) = 0.1mol/L
D.反应H₃PO₃ + HPO₃²⁻ 2H₂PO₃⁻的平衡常数K = 1.0×10⁻⁵.³
 。25℃时,某亚磷酸溶液中含磷微粒的浓度之和为0.1mol/L,溶液中所有含磷微粒的pc与pOH的关系如图所示。
。25℃时,某亚磷酸溶液中含磷微粒的浓度之和为0.1mol/L,溶液中所有含磷微粒的pc与pOH的关系如图所示。
已知:pc = -lg c,pOH = -lg c(OH⁻),下列说法正确的是(
C
)A.亚磷酸溶液中:c(H⁺) = c(H₂PO₃⁻) + 2c(HPO₃²⁻) + 3c(PO₃³⁻) + c(OH⁻)
B.水的电离程度:x < y < z
C.溶液pH = 4时:c(H₂PO₃⁻) + 2c(HPO₃²⁻) = 0.1mol/L
D.反应H₃PO₃ + HPO₃²⁻ 2H₂PO₃⁻的平衡常数K = 1.0×10⁻⁵.³
答案:
14.[答案] C
[分析] 任何pH下,图中含磷物质均有3种,分别为H₃PO₃、H₂PO₃⁻和HPO₃²⁻,随着pH增大,c(OH⁻)逐渐增大,根据H₃PO₃+OH⁻⇌H₂PO₃⁻+H₂O、H₂PO₃⁻+OH⁻⇌HPO₃²⁻+H₂O,可知c(H₃PO₃)逐渐减小,c(H₂PO₃⁻)先增大后减小,c(HPO₃²⁻)逐渐增大,故pc(H₃PO₃)逐渐增大,pc(H₂PO₃⁻)先减小后增大,pc(HPO₃²⁻)逐渐减小,故曲线①表示c(HPO₃²⁻),曲线②表示c(H₂PO₃⁻),曲线③表示c(H₃PO₃),据此分析解题。
[解析] A.亚磷酸为二元酸溶液显电中性,则c(H⁺)=c(H₂PO₃⁻)+2c(HPO₃²⁻)+c(OH⁻),A 错误。
B.pOH越大,氢离子浓度越大,水电离的抑制程度就越大,水的电离程度:x>y>z,B错误。
C.pH=4时,pOH=10,由图可知,此时pc(H₃PO₃)=pc(H₂PO₃⁻),即c(H₃PO₃)=c(H₂PO₃⁻),而c(H₃PO₃)+c(H₂PO₃⁻)+c(HPO₃²⁻)=0.1mol·L⁻¹,故2c(H₃PO₃)+c(HPO₃²⁻)=0.1mol·L⁻¹,C正确。
D.根据x点知,c(HPO₃²⁻)=c(H₂PO₃⁻)时,pOH=7.3,c(OH⁻)=10⁻⁷.³mol/L,c(H⁺)=10⁻⁶.⁷mol/L,则H₃PO₃的K_a2=$\frac{c(H^+) × c(HPO_3^{2-})}{c(H_2PO_3^-)}$=c(H⁺)=10⁻⁶.⁷,根据z点知,c(H₂PO₃⁻)=c(HPO₃²⁻),pOH=12.6,c(OH⁻)=10⁻¹².⁶mol/L,c(H⁺)=10⁻¹.⁴mol/L,则H₃PO₃的K_a1=$\frac{c(H^+) × c(H_2PO_3^-)}{c(H_3PO_3)}$=c(H⁺)=10⁻¹.⁴,由H₃PO₃⇌H₂PO₃⁻+H⁺减去H₂PO₃⁻⇌HPO₃²⁻+H⁺,可得H₃PO₃+HPO₃²⁻⇌2H₂PO₃⁻,则平衡常数K=$\frac{K_{a1}}{K_{a2}}$=$\frac{10^{-1.4}}{10^{-6.7}}$=10⁵.³,D错误。
故答案为C。
[分析] 任何pH下,图中含磷物质均有3种,分别为H₃PO₃、H₂PO₃⁻和HPO₃²⁻,随着pH增大,c(OH⁻)逐渐增大,根据H₃PO₃+OH⁻⇌H₂PO₃⁻+H₂O、H₂PO₃⁻+OH⁻⇌HPO₃²⁻+H₂O,可知c(H₃PO₃)逐渐减小,c(H₂PO₃⁻)先增大后减小,c(HPO₃²⁻)逐渐增大,故pc(H₃PO₃)逐渐增大,pc(H₂PO₃⁻)先减小后增大,pc(HPO₃²⁻)逐渐减小,故曲线①表示c(HPO₃²⁻),曲线②表示c(H₂PO₃⁻),曲线③表示c(H₃PO₃),据此分析解题。
[解析] A.亚磷酸为二元酸溶液显电中性,则c(H⁺)=c(H₂PO₃⁻)+2c(HPO₃²⁻)+c(OH⁻),A 错误。
B.pOH越大,氢离子浓度越大,水电离的抑制程度就越大,水的电离程度:x>y>z,B错误。
C.pH=4时,pOH=10,由图可知,此时pc(H₃PO₃)=pc(H₂PO₃⁻),即c(H₃PO₃)=c(H₂PO₃⁻),而c(H₃PO₃)+c(H₂PO₃⁻)+c(HPO₃²⁻)=0.1mol·L⁻¹,故2c(H₃PO₃)+c(HPO₃²⁻)=0.1mol·L⁻¹,C正确。
D.根据x点知,c(HPO₃²⁻)=c(H₂PO₃⁻)时,pOH=7.3,c(OH⁻)=10⁻⁷.³mol/L,c(H⁺)=10⁻⁶.⁷mol/L,则H₃PO₃的K_a2=$\frac{c(H^+) × c(HPO_3^{2-})}{c(H_2PO_3^-)}$=c(H⁺)=10⁻⁶.⁷,根据z点知,c(H₂PO₃⁻)=c(HPO₃²⁻),pOH=12.6,c(OH⁻)=10⁻¹².⁶mol/L,c(H⁺)=10⁻¹.⁴mol/L,则H₃PO₃的K_a1=$\frac{c(H^+) × c(H_2PO_3^-)}{c(H_3PO_3)}$=c(H⁺)=10⁻¹.⁴,由H₃PO₃⇌H₂PO₃⁻+H⁺减去H₂PO₃⁻⇌HPO₃²⁻+H⁺,可得H₃PO₃+HPO₃²⁻⇌2H₂PO₃⁻,则平衡常数K=$\frac{K_{a1}}{K_{a2}}$=$\frac{10^{-1.4}}{10^{-6.7}}$=10⁵.³,D错误。
故答案为C。
15.(14分)(2025·四川·二模)铬酰氯(CrO₂Cl₂,M = 155 g·mol⁻¹)为深红棕色液体,沸点为117℃,易挥发、易水解。在有机合成领域中有着重要用途。铬酰氯制备方法之一是重铬酸钾法,其制备操作步骤如下:
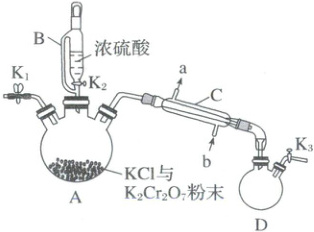
①如图连接好装置,检查气密性,装入药品;
②向14.7g K₂Cr₂O₇(M = 294 g·mol⁻¹)与29.8g KCl混合粉末中滴入浓硫酸,控温10℃,充分反应;
③一系列操作……;
④用D装置收集铬酰氯。
回答下列问题:
(1)C装置的名称是________;该实验中浓硫酸除了作反应物,还有一个重要作用是________。
(2)该制备的反应机理为:浓硫酸先与氯化钾反应生成HCl气体,HCl再与K₂Cr₂O₇反应生成铬酰氯。写出HCl与K₂Cr₂O₇反应生成铬酰氯的化学方程式:________。
(3)步骤②控温10℃,也可改为先将浓硫酸在反应前放入冰箱中冷却至0℃左右,这是为了防止________。
(4)步骤③“一系列操作”(开关的开闭略去)包括下列操作,其操作顺序为(填序号)。
①通入CO₂至D装置液面不再上升
②加热A装置至117℃
③通入N₂,排尽空气
④通冷凝水
(5)收集117℃左右的馏分时发现D中充满红棕色气体,几乎没有收集到液体,请改进装置:________。
(6)图中缺少尾气处理装置,下图所示的尾气处理装置中最合理的是(填序号)。
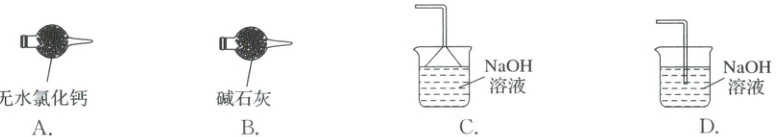
(7)本实验的产率为80.0%,则制得的铬酰氯(CrO₂Cl₂)的质量为。

①如图连接好装置,检查气密性,装入药品;
②向14.7g K₂Cr₂O₇(M = 294 g·mol⁻¹)与29.8g KCl混合粉末中滴入浓硫酸,控温10℃,充分反应;
③一系列操作……;
④用D装置收集铬酰氯。
回答下列问题:
(1)C装置的名称是________;该实验中浓硫酸除了作反应物,还有一个重要作用是________。
(2)该制备的反应机理为:浓硫酸先与氯化钾反应生成HCl气体,HCl再与K₂Cr₂O₇反应生成铬酰氯。写出HCl与K₂Cr₂O₇反应生成铬酰氯的化学方程式:________。
(3)步骤②控温10℃,也可改为先将浓硫酸在反应前放入冰箱中冷却至0℃左右,这是为了防止________。
(4)步骤③“一系列操作”(开关的开闭略去)包括下列操作,其操作顺序为(填序号)。
①通入CO₂至D装置液面不再上升
②加热A装置至117℃
③通入N₂,排尽空气
④通冷凝水
(5)收集117℃左右的馏分时发现D中充满红棕色气体,几乎没有收集到液体,请改进装置:________。
(6)图中缺少尾气处理装置,下图所示的尾气处理装置中最合理的是(填序号)。

(7)本实验的产率为80.0%,则制得的铬酰氯(CrO₂Cl₂)的质量为。
答案:
15.[答案]
(1)直形冷凝管 吸水剂(或干燥剂)
(2)K₂Cr₂O₇+6HCl══2CrO₂Cl₂+2KCl+3H₂O
(3)反应温度过高,反应速率过快,同时防止产生的HCl挥发
(4)③④②①
(5)将装置D置于冰水浴
(6)B
(7)12.4g
[分析] 铬酰氯常温下为深红棕色液体,放置在空气中会迅速挥发并水解,在实验中可用重铬酸钾、浓硫酸与氯化钾制备;反应原理为:浓硫酸先与氯化钾反应生成HCl气体,HCl再与K₂Cr₂O₇反应生成铬酰氯;尾气中有未反应的HCl和未被冷凝的铬酰氯蒸汽,吸收尾气时,需防止产物与空气及水蒸气接触。
[解析]
(1)C装置是用于冷凝的直形冷凝管;铬酰氯遇水要水解,反应中也会生成一定量的水,故需要吸水剂,所以浓硫酸同时吸收反应体系的水。
(2)根据信息,HCl与K₂Cr₂O₇反应生成铬酰氯的化学方程式为K₂Cr₂O₇+6HCl══2CrO₂Cl₂+2KCl+3H₂O。
(3)反应温度仅10℃,铬酰氯挥发的温度是117℃,故不是为了防止它的挥发,题中也未涉及副反应或催化剂等,所以低温是为了防止温度偏高,反应速率过快,同时考虑生成的HCl易挥发。
(4)从给的四步操作可以确定需先排出空气,防止后续反应体系中有水使铬酰氯水解;加热前需要先通冷凝水;反应结束需要再鼓气将导管中的铬酰氯全部鼓入D装置,故排序为③④②①。
(5)装置中充满红棕色气体,说明水未能将铬酰氯蒸气冷凝,冰水浴温度较低,可使铬酰氯蒸气液化并减少液态铬酰氯的挥发,所以需要将D装置置于冰水中。
(6)碱石灰可吸收未反应的氯化氢气体和未冷凝的铬酰氯蒸气,并可防止空气中的水蒸气进入装置,故选B。
(7)利用反应K₂Cr₂O₇+6HCl══2CrO₂Cl₂+2KCl+3H₂O,可得CrO₂Cl₂的质量为$\frac{14.7g}{294g/mol}$×2×155g/mol×80%=12.4g。
(1)直形冷凝管 吸水剂(或干燥剂)
(2)K₂Cr₂O₇+6HCl══2CrO₂Cl₂+2KCl+3H₂O
(3)反应温度过高,反应速率过快,同时防止产生的HCl挥发
(4)③④②①
(5)将装置D置于冰水浴
(6)B
(7)12.4g
[分析] 铬酰氯常温下为深红棕色液体,放置在空气中会迅速挥发并水解,在实验中可用重铬酸钾、浓硫酸与氯化钾制备;反应原理为:浓硫酸先与氯化钾反应生成HCl气体,HCl再与K₂Cr₂O₇反应生成铬酰氯;尾气中有未反应的HCl和未被冷凝的铬酰氯蒸汽,吸收尾气时,需防止产物与空气及水蒸气接触。
[解析]
(1)C装置是用于冷凝的直形冷凝管;铬酰氯遇水要水解,反应中也会生成一定量的水,故需要吸水剂,所以浓硫酸同时吸收反应体系的水。
(2)根据信息,HCl与K₂Cr₂O₇反应生成铬酰氯的化学方程式为K₂Cr₂O₇+6HCl══2CrO₂Cl₂+2KCl+3H₂O。
(3)反应温度仅10℃,铬酰氯挥发的温度是117℃,故不是为了防止它的挥发,题中也未涉及副反应或催化剂等,所以低温是为了防止温度偏高,反应速率过快,同时考虑生成的HCl易挥发。
(4)从给的四步操作可以确定需先排出空气,防止后续反应体系中有水使铬酰氯水解;加热前需要先通冷凝水;反应结束需要再鼓气将导管中的铬酰氯全部鼓入D装置,故排序为③④②①。
(5)装置中充满红棕色气体,说明水未能将铬酰氯蒸气冷凝,冰水浴温度较低,可使铬酰氯蒸气液化并减少液态铬酰氯的挥发,所以需要将D装置置于冰水中。
(6)碱石灰可吸收未反应的氯化氢气体和未冷凝的铬酰氯蒸气,并可防止空气中的水蒸气进入装置,故选B。
(7)利用反应K₂Cr₂O₇+6HCl══2CrO₂Cl₂+2KCl+3H₂O,可得CrO₂Cl₂的质量为$\frac{14.7g}{294g/mol}$×2×155g/mol×80%=12.4g。
查看更多完整答案,请扫码查看


