2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第26页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
3. 低碳烯烃(乙烯、丙烯、丁烯等)作为重要的基本化工原料,在现代石油和化学工业中具有举足轻重的作用。
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原NO。
已知C₃H₆(g)+9NO(g)=9/2N₂(g)+3CO₂(g)+3H₂O(g) ΔH=-2838.4kJ·mol⁻¹
C₃H₆(g)+9/2O₂(g)=3CO₂(g)+3H₂O(g) ΔH=-2025.7kJ·mol⁻¹
(1)反应2NO(g)=N₂(g)+O₂(g) ΔH=
Ⅱ.二氧化碳可将乙烷转化为更有工业价值的乙烯。相同反应时间,不同温度、不同催化剂的条件下测得的数据如表1(均未达到平衡状态):
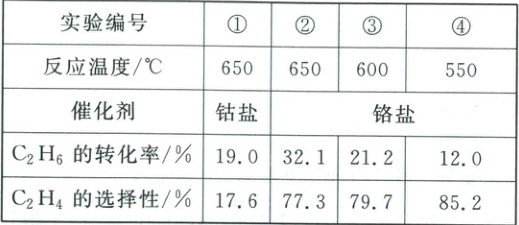
表1
(2)已知C₂H₄选择性为转化的乙烷中生成乙烯的百分比。反应温度为650℃时,较优的催化剂为______(填“钴盐”或“铬盐”)。对比实验②③④可得出结论:______(从温度对C₂H₆的转化率和C₂H₄的选择性的影响角度分析)。
Ⅲ.一定条件下,碘甲烷(CH₃I)热裂解制低碳烯烃的主要反应有:
反应ⅰ:2CH₃I(g)⇌C₂H₄(g)+2HI(g) ΔH₁ Kₚ₁=a
反应ⅱ:3C₂H₄(g)⇌2C₃H₆(g) ΔH₂ Kₚ₂=b
反应ⅲ:2C₂H₄(g)⇌C₄H₈(g) ΔH₃ Kₚ₃=c
反应ⅰ、ⅱ、ⅲ在不同温度下的分压平衡常数Kₚ的数值如表2,回答下列问题:

表2
(3)根据表中数据推出反应ⅰ的活化能Eₐ(正)
(4)实际工业生产中,若存在副反应:4C₃H₆(g)⇌3C₄H₈(g) ΔH₄ Kₚ₄,结合表2数据分析ΔH₄______(填“>”或“<”)0,陈述理由:______。
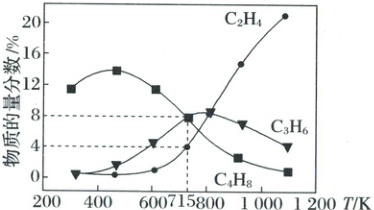
(5)其他条件不变,起始压强为0.1aMPa,向容积为1L的恒容密闭容器中投入1molCH₃I(g),只发生反应ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯的物质的量分数的影响如图。
①下列一定能说明该体系达到平衡状态的是
A. CH₃I的转化率达到最大值
B. v(CH₃I)=v(HI)
C. 气体的密度不再发生变化
D. 各气体组分的百分含量保持不变
②715K条件下,平衡时,体系中m(C₂H₄):m(C₃H₆):m(C₄H₈)=
Ⅰ.小分子烃类(如丙烯)作为还原剂可以在催化剂上选择性还原NO。
已知C₃H₆(g)+9NO(g)=9/2N₂(g)+3CO₂(g)+3H₂O(g) ΔH=-2838.4kJ·mol⁻¹
C₃H₆(g)+9/2O₂(g)=3CO₂(g)+3H₂O(g) ΔH=-2025.7kJ·mol⁻¹
(1)反应2NO(g)=N₂(g)+O₂(g) ΔH=
-180.6
kJ·mol⁻¹。Ⅱ.二氧化碳可将乙烷转化为更有工业价值的乙烯。相同反应时间,不同温度、不同催化剂的条件下测得的数据如表1(均未达到平衡状态):

表1
(2)已知C₂H₄选择性为转化的乙烷中生成乙烯的百分比。反应温度为650℃时,较优的催化剂为______(填“钴盐”或“铬盐”)。对比实验②③④可得出结论:______(从温度对C₂H₆的转化率和C₂H₄的选择性的影响角度分析)。
Ⅲ.一定条件下,碘甲烷(CH₃I)热裂解制低碳烯烃的主要反应有:
反应ⅰ:2CH₃I(g)⇌C₂H₄(g)+2HI(g) ΔH₁ Kₚ₁=a
反应ⅱ:3C₂H₄(g)⇌2C₃H₆(g) ΔH₂ Kₚ₂=b
反应ⅲ:2C₂H₄(g)⇌C₄H₈(g) ΔH₃ Kₚ₃=c
反应ⅰ、ⅱ、ⅲ在不同温度下的分压平衡常数Kₚ的数值如表2,回答下列问题:

表2
(3)根据表中数据推出反应ⅰ的活化能Eₐ(正)
>
(填“>”或“<”)Eₐ(逆)。(4)实际工业生产中,若存在副反应:4C₃H₆(g)⇌3C₄H₈(g) ΔH₄ Kₚ₄,结合表2数据分析ΔH₄______(填“>”或“<”)0,陈述理由:______。
(5)其他条件不变,起始压强为0.1aMPa,向容积为1L的恒容密闭容器中投入1molCH₃I(g),只发生反应ⅰ、ⅱ、ⅲ,反应温度对平衡体系中乙烯、丙烯和丁烯的物质的量分数的影响如图。

①下列一定能说明该体系达到平衡状态的是
D
(填字母)。A. CH₃I的转化率达到最大值
B. v(CH₃I)=v(HI)
C. 气体的密度不再发生变化
D. 各气体组分的百分含量保持不变
②715K条件下,平衡时,体系中m(C₂H₄):m(C₃H₆):m(C₄H₈)=
1:3:4
。反应ⅰ的压强平衡常数Kₚ=0.08a
MPa。
答案:
(1)-180.6
(2)铬盐 C₂H₆的转化率随温度升高逐渐增大,但C₂H₄的选择性随温度的升高而逐渐减小
(3)>
(4)< 升高温度,副反应的分压平衡常数减小,说明平衡向逆反应方向移动,该反应为放热反应,ΔH₄<0
(5)①D ②1:3:4 0.08a
(1)-180.6
(2)铬盐 C₂H₆的转化率随温度升高逐渐增大,但C₂H₄的选择性随温度的升高而逐渐减小
(3)>
(4)< 升高温度,副反应的分压平衡常数减小,说明平衡向逆反应方向移动,该反应为放热反应,ΔH₄<0
(5)①D ②1:3:4 0.08a
查看更多完整答案,请扫码查看


