2026年一本密卷高考化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年一本密卷高考化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
16.(14分)(2025·广西柳州·模拟预测)铍广泛用于航空航天、电子元件、导弹与武器制造等领域。一种以铍矿石(主要成分为Be₂SiO₄,还含有少量MnO等)为原料制备铍的工艺流程图如图。

已知:①“烧结”时,未发生氧化还原反应;“烧结”后,Be、Mn元素分别转化成可溶性的Na₂BeF₄、Na₂MnF₄,其他元素以稳定的氧化物形式存在。
②铁冰晶石的成分为Na₃FeF₆。
回答下列问题:
(1)在元素周期表中,Be与Al处于对角线的位置,性质相似。下列叙述错误的是(填标号)。
A. Be只能与酸反应,不能与碱反应
B. BeO具有高熔点,能耐酸碱腐蚀
C. 常温下,BeCl₂溶液的pH < 7
D. BeCl₂是共价化合物
(2)Na₃FeF₆中Fe的化合价为。
(3)“烧结”时,不宜采用陶瓷类器材,原因是________。
(4)“沉铍”步骤中加入NaOH溶液调节pH为11,析出颗粒状的Be(OH)₂,写出生成Be(OH)₂的离子方程式:;若加入的NaOH溶液过量,得到的含铍粒子是(填离子符号)。
(5)焦炭还原法和镁还原法制铍单质都在氩气中进行,氩气的作用是________;写出镁还原法的反应原理:________。
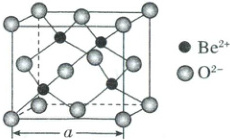
(6)BeO晶体是制备氟硼铍酸钾晶体的原料,其晶胞结构如图所示。若该晶体的密度为d g·cm⁻³,则晶胞参数a = nm(用含d、Nₐ的代数式表示)。

已知:①“烧结”时,未发生氧化还原反应;“烧结”后,Be、Mn元素分别转化成可溶性的Na₂BeF₄、Na₂MnF₄,其他元素以稳定的氧化物形式存在。
②铁冰晶石的成分为Na₃FeF₆。
回答下列问题:
(1)在元素周期表中,Be与Al处于对角线的位置,性质相似。下列叙述错误的是(填标号)。
A. Be只能与酸反应,不能与碱反应
B. BeO具有高熔点,能耐酸碱腐蚀
C. 常温下,BeCl₂溶液的pH < 7
D. BeCl₂是共价化合物
(2)Na₃FeF₆中Fe的化合价为。
(3)“烧结”时,不宜采用陶瓷类器材,原因是________。
(4)“沉铍”步骤中加入NaOH溶液调节pH为11,析出颗粒状的Be(OH)₂,写出生成Be(OH)₂的离子方程式:;若加入的NaOH溶液过量,得到的含铍粒子是(填离子符号)。
(5)焦炭还原法和镁还原法制铍单质都在氩气中进行,氩气的作用是________;写出镁还原法的反应原理:________。
(6)BeO晶体是制备氟硼铍酸钾晶体的原料,其晶胞结构如图所示。若该晶体的密度为d g·cm⁻³,则晶胞参数a = nm(用含d、Nₐ的代数式表示)。

答案:
16.[答案]
(1)AB
(2)+3
(3)陶瓷中含有的二氧化硅会与碳酸钠反应
(4)BeF₄²⁻+2OH⁻══Be(OH)₂↓+4F⁻;[Be(OH)₄]²⁻
(5)保护Be和Mg不被氧化 BeO+Mg$\stackrel{高温}{=\!=\!=}$MgO+Be
(6)$\frac{\sqrt[3]{4×25}}{N_Ad}$×10⁷
[分析] 以铍矿石(主要成分为Be₂SiO₄,还含有少量MnO等)为原料制备铍,铍矿石加入Na₂SiF₆、Na₂CO₃烧结,烧结时,未发生氧化还原反应,烧结后,Be、Mn元素以可溶性的Na₂BeF₄、Na₂MnF₄形式存在,同时生成二氧化硅,加入水浸出,过滤,所得滤渣为二氧化硅,滤液中加入NH₃·H₂O、KMnO₄得到MnO₂固体,过滤得到MnO₂,滤液中加入NaOH沉铍,过滤得到的滤渣洗涤烘干然后煅烧得到工业BeO,BeO可以通过焦炭还原法或者镁还原法制得金属Be,滤液中加入硫酸铁得到铁冰晶石,据此分析。
[解析]
(1)Be与Al处于对角线的位置,它们的性质相似;
A.Al与酸碱均反应,可知Be也与酸碱均反应,故A错误。
B.氧化铝的熔点高,可知氧化铍具有高熔点,与氧化铝类似,氧化铍既能与酸反应又能与碱反应,因此不耐酸碱腐蚀,故B错误。
C.氯化铝水解显酸性,可知常温时,BeCl₂也可以水解使溶液的pH<7,故C正确。
D.AlCl₃是共价化合物,可知BeCl₂也是共价化合物,D正确。
故选AB。
(2)Na₃FeF₆中Na为+1价,F为−1价,根据化合价代数和为零可知Fe的化合价为+3。
(3)陶瓷中含有二氧化硅,高温时可以与碳酸钠反应,故“烧结”时不宜采用陶瓷类器材。
(4)沉铍时,溶液中的Na₂BeF₄与NaOH反应生成Be(OH)₂,反应的离子方程式为BeF₄²⁻+2OH⁻══Be(OH)₂↓+4F⁻;Be(OH)₂和Al(OH)₃性质相似,能和足量NaOH溶液反应生成Na₂[Be(OH)₄],含铍的离子为[Be(OH)₄]²⁻。
(5)焦炭还原法和镁还原法制铍单质都在氩气中进行,氩气的作用是防止空气与铍、镁反应,保护Be和Mg不被氧化;镁还原法制铍单质是用单质镁与BeO高温下反应生成Be和MgO,反应方程式为BeO+Mg$\stackrel{高温}{=\!=\!=}$Be+MgO。
(6)设晶胞参数为anm,用N_A表示阿伏加德罗常数的值,该晶胞中,O²⁻个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Be²⁺原子数为4,则BeO晶体的密度为d=$\frac{m}{V}$=$\frac{\frac{4×25}{N_A}g}{(a×10^{-7}cm)^3}$=$\frac{\sqrt[3]{4×25}}{N_Ad}$×10⁷nm。
(1)AB
(2)+3
(3)陶瓷中含有的二氧化硅会与碳酸钠反应
(4)BeF₄²⁻+2OH⁻══Be(OH)₂↓+4F⁻;[Be(OH)₄]²⁻
(5)保护Be和Mg不被氧化 BeO+Mg$\stackrel{高温}{=\!=\!=}$MgO+Be
(6)$\frac{\sqrt[3]{4×25}}{N_Ad}$×10⁷
[分析] 以铍矿石(主要成分为Be₂SiO₄,还含有少量MnO等)为原料制备铍,铍矿石加入Na₂SiF₆、Na₂CO₃烧结,烧结时,未发生氧化还原反应,烧结后,Be、Mn元素以可溶性的Na₂BeF₄、Na₂MnF₄形式存在,同时生成二氧化硅,加入水浸出,过滤,所得滤渣为二氧化硅,滤液中加入NH₃·H₂O、KMnO₄得到MnO₂固体,过滤得到MnO₂,滤液中加入NaOH沉铍,过滤得到的滤渣洗涤烘干然后煅烧得到工业BeO,BeO可以通过焦炭还原法或者镁还原法制得金属Be,滤液中加入硫酸铁得到铁冰晶石,据此分析。
[解析]
(1)Be与Al处于对角线的位置,它们的性质相似;
A.Al与酸碱均反应,可知Be也与酸碱均反应,故A错误。
B.氧化铝的熔点高,可知氧化铍具有高熔点,与氧化铝类似,氧化铍既能与酸反应又能与碱反应,因此不耐酸碱腐蚀,故B错误。
C.氯化铝水解显酸性,可知常温时,BeCl₂也可以水解使溶液的pH<7,故C正确。
D.AlCl₃是共价化合物,可知BeCl₂也是共价化合物,D正确。
故选AB。
(2)Na₃FeF₆中Na为+1价,F为−1价,根据化合价代数和为零可知Fe的化合价为+3。
(3)陶瓷中含有二氧化硅,高温时可以与碳酸钠反应,故“烧结”时不宜采用陶瓷类器材。
(4)沉铍时,溶液中的Na₂BeF₄与NaOH反应生成Be(OH)₂,反应的离子方程式为BeF₄²⁻+2OH⁻══Be(OH)₂↓+4F⁻;Be(OH)₂和Al(OH)₃性质相似,能和足量NaOH溶液反应生成Na₂[Be(OH)₄],含铍的离子为[Be(OH)₄]²⁻。
(5)焦炭还原法和镁还原法制铍单质都在氩气中进行,氩气的作用是防止空气与铍、镁反应,保护Be和Mg不被氧化;镁还原法制铍单质是用单质镁与BeO高温下反应生成Be和MgO,反应方程式为BeO+Mg$\stackrel{高温}{=\!=\!=}$Be+MgO。
(6)设晶胞参数为anm,用N_A表示阿伏加德罗常数的值,该晶胞中,O²⁻个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Be²⁺原子数为4,则BeO晶体的密度为d=$\frac{m}{V}$=$\frac{\frac{4×25}{N_A}g}{(a×10^{-7}cm)^3}$=$\frac{\sqrt[3]{4×25}}{N_Ad}$×10⁷nm。
查看更多完整答案,请扫码查看


