第98页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
1. A (2024 秋·天津红桥区期中)化学反应前后一定不变的是(
①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量
A. ①②⑥
B. ①④⑥
C. ②③⑤
D. ①③⑤⑥
D
)①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量
A. ①②⑥
B. ①④⑥
C. ②③⑤
D. ①③⑤⑥
答案:
D
2. A (2024 秋·江苏泰州期中)氨气和氧气可以发生化学反应,但当反应条件或氧气浓度不同时,所得产物也不同。下列物质不可能是由氨气和氧气反应生成的是(
A. N₂和 H₂O
B. NO 和 H₂O
C. CO₂和 H₂O
D. NO₂和 H₂O
C
)A. N₂和 H₂O
B. NO 和 H₂O
C. CO₂和 H₂O
D. NO₂和 H₂O
答案:
C
3. A 现将 20g A 和足量 B 在一定条件下充分反应,生成 16g C 和 11g D,则参加反应的 A 和 B 的质量比是(
A. 20:11
B. 20:7
C. 5:4
D. 16:11
B
)A. 20:11
B. 20:7
C. 5:4
D. 16:11
答案:
B
4. B 将一定量的 N₂、H₂和物质 M 置于密闭容器中,在特定条件下发生化学反应,反应前后各物质的质量分数如图所示。下列说法不正确的是( )
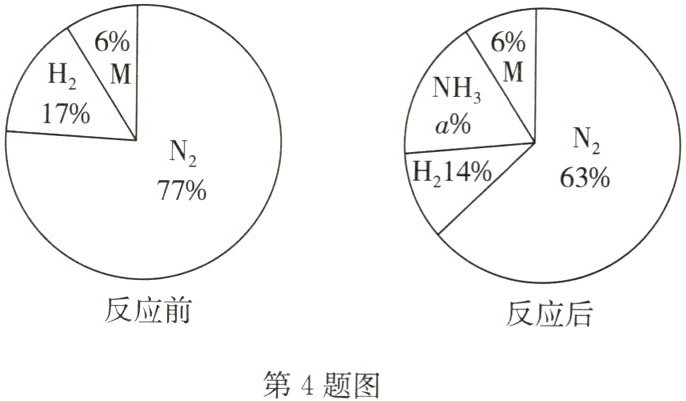
A. 反应前后原子的数目不变
B. 参加反应的 N₂和 H₂分子个数比为 1:3
C. M 可能是该反应的催化剂
D. 反应后 H₂和 NH₃质量分数比为 1:1

A. 反应前后原子的数目不变
B. 参加反应的 N₂和 H₂分子个数比为 1:3
C. M 可能是该反应的催化剂
D. 反应后 H₂和 NH₃质量分数比为 1:1
答案:
D 点拨:根据质量守恒定律可得,反应前后原子的数目不变,故 A 正确;由图示可知,参加反应的 $N_{2}$ 和 $H_{2}$ 的质量比为 $(77\%-63\%):(17\%-14\%) = 14:3$,因此参加反应的 $N_{2}$ 和 $H_{2}$ 的分子个数比 $(14/28):(3/2) = 1:3$,故 B 正确;反应前后 M 的质量分数不变,则 M 可能是催化剂或不参加反应,故 C 正确;反应后 $H_{2}$ 和 $NH_{3}$ 的质量分数比为 $14\%:(1 - 14\% - 63\% - 6\%) = 14:17$,故 D 错误。故本题选 D。
5. A (2024 秋·江西南昌县期末)下列现象符合质量守恒定律的是(
A. 2L 氢气与 18L 氧气反应生成 20L 的水
B. ag 铁在 bg 氧气中燃烧,生成四氧化三铁的质量不大于(a + b)g
C. 在一定条件下,可用氢气和氯气作原料制得水
D. 12g 碳在 12g 氧气中完全燃烧生成 24g 二氧化碳
B
)A. 2L 氢气与 18L 氧气反应生成 20L 的水
B. ag 铁在 bg 氧气中燃烧,生成四氧化三铁的质量不大于(a + b)g
C. 在一定条件下,可用氢气和氯气作原料制得水
D. 12g 碳在 12g 氧气中完全燃烧生成 24g 二氧化碳
答案:
B
6. B 天然气的主要成分是甲烷(CH₄)。当氧气不足时,甲烷燃烧会生成 CO₂、CO 和 H₂O,若 16g 甲烷燃烧生成 CO₂和 CO 的质量比为 11:7,则参加反应的 O₂的质量为(
A. 48g
B. 56g
C. 64g
D. 72g
B
)A. 48g
B. 56g
C. 64g
D. 72g
答案:
B 点拨:16g 甲烷中碳元素的质量为 $16g×(12/16×100\%) = 12g$。设生成二氧化碳的质量为 $11x$,则一氧化碳的质量为 $7x$, $11x×(12/44×100\%) + 7x×(12/28×100\%) = 12g$,解得 $x = 2g$,则二氧化碳的质量为 22g,一氧化碳的质量为 14g;16g 甲烷中氢元素的质量为 $16g - 12g = 4g$,则生成水的质量为 $4g÷[(1×2)/18×100\%] = 36g$,参加反应的 $O_{2}$ 的质量为 $22g + 14g + 36g - 16g = 56g$。故本题选 B。
7. B 将 0.72g 草酸亚铁(FeC₂O₄)放在一个可称量的敞口容器中高温焙烧,500~600℃时,容器中的固体质量保持 0.4g 不变。所得物质的化学式为(
A. Fe
B. FeO
C. Fe₂O₃
D. Fe₃O₄
C
)A. Fe
B. FeO
C. Fe₂O₃
D. Fe₃O₄
答案:
C 点拨:0.72g 草酸亚铁中含铁元素的质量为 $0.72g×(56/144×100\%) = 0.28g$,而反应后固体质量为 0.4g,不可能是铁单质,结合选项可知,应为铁的氧化物,铁元素和氧元素的质量比为 $0.28g:(0.4g - 0.28g) = 7:3$,设铁的氧化物的化学式为 $Fe_{x}O_{y}$,则 $56x:16y = 7:3$,则 $x:y = 2:3$,故所得物质的化学式为 $Fe_{2}O_{3}$。故本题选 C。
8. B (2023·四川乐山)已知物质 R 由一种或多种物质组成。取一定质量的 R 在足量的氧气中完全燃烧,生成 4.4g 二氧化碳和 3.6g 水,下列分析不正确的是(
A. 参加反应的 R 和氧气的质量总和一定等于 8.0g
B. 所取 R 质量的最小值为 1.6g
C. R 可能是酒精(C₂H₅OH)
D. 若 R 为 CO 和 H₂的混合物,则 CO 和 H₂的分子个数比为 1:2
C
)A. 参加反应的 R 和氧气的质量总和一定等于 8.0g
B. 所取 R 质量的最小值为 1.6g
C. R 可能是酒精(C₂H₅OH)
D. 若 R 为 CO 和 H₂的混合物,则 CO 和 H₂的分子个数比为 1:2
答案:
C 点拨:根据质量守恒定律,反应前反应物的总质量等于反应后生成物的总质量,反应后的二氧化碳和水一共为 $4.4g + 3.6g = 8g$,故反应前参加反应的 R 和氧气的质量总和也为 8g,故 A 分析正确;反应后的二氧化碳中碳元素的质量为 $4.4g×(12/44×100\%) = 1.2g$,水中氢元素的质量为 $3.6g×(2/18×100\%) = 0.4g$,根据反应前后元素的种类和质量保持不变,故反应前 R 中的碳元素和氢元素分别为 1.2g 和 0.4g,由于反应前后必须满足元素守恒,故 R 至少由 C、H 两种元素组成,因此 R 质量的最小值为 $1.2g + 0.4g = 1.6g$,故 B 分析正确;由 B 可知 R 中 C、H 元素质量比为 $1.2g:0.4g = 3:1$,而酒精 $(C_{2}H_{5}OH)$ 中 C、H 元素质量比为 $(2×12):(6×1) = 4:1$,故 C 分析错误;由 R 中 C、H 原子个数比为 $(1.2g÷12):(0.4g÷1) = 1:4$ 可知,若 R 为 CO 和 $H_{2}$ 的混合物,则 CO 和 $H_{2}$ 的分子中 C、H 原子个数比也是 $1:4$,因一个 $H_{2}$ 分子由两个氢原子构成,故 CO 和 $H_{2}$ 的分子个数比为 $1:(4÷2) = 1:2$,故 D 分析正确。故本题选 C。
查看更多完整答案,请扫码查看


