第103页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
12. B (2023 秋·江苏苏州月考)根据信息书写化学方程式并回答相关问题。
(1)氨气$(NH_{3})$完全燃烧的一种生成物是空气中含量最多的物质,另一种生成物是生活中最常见的液体。该反应的化学方程式为
(2)工业制取记忆合金中的钛,先用热浓硫酸处理钛铁矿(主要成分为$FeTiO_{3}$),反应中元素化合价不变,得到硫酸钛$[Ti(SO_{4})_{2}]$、硫酸亚铁和一种氧化物。$FeTiO_{3}$中钛元素的化合价为
(3)天然气(主要成分是$CH_{4}$)是重要的化工原料。一定条件下$CH_{4}$与$CO_{2}$反应生成 CO 和$H_{2}$,该反应的化学方程式是
(4)$CO_{2}$是一种宝贵的资源,科学家发现了一种固定和利用$CO_{2}$的方法:在高温、高压下,用$CO_{2}$和$NH_{3}$合成尿素$[CO(NH_{2})_{2}]$,同时生成水。该反应的化学方程式为
(5)工业上以食盐(NaCl)和水为反应物,通过电解制取氯气$(Cl_{2})$,同时得到烧碱(NaOH)和一种最轻的气体,该反应的化学方程式为
(1)氨气$(NH_{3})$完全燃烧的一种生成物是空气中含量最多的物质,另一种生成物是生活中最常见的液体。该反应的化学方程式为
$ {4NH_{3} + 3O_{2}\xlongequal{点燃}2N_{2} + 6H_{2}O} $
。(2)工业制取记忆合金中的钛,先用热浓硫酸处理钛铁矿(主要成分为$FeTiO_{3}$),反应中元素化合价不变,得到硫酸钛$[Ti(SO_{4})_{2}]$、硫酸亚铁和一种氧化物。$FeTiO_{3}$中钛元素的化合价为
+4 价
,化学方程式为 $ {FeTiO_{3} + 3H_{2}SO_{4}(浓)\xlongequal{\triangle}Ti(SO_{4})_{2} + FeSO_{4} + 3H_{2}O} $
。(3)天然气(主要成分是$CH_{4}$)是重要的化工原料。一定条件下$CH_{4}$与$CO_{2}$反应生成 CO 和$H_{2}$,该反应的化学方程式是
$ {CH_{4} + CO_{2}\xlongequal{一定条件}2CO + 2H_{2}} $
;CO 和$H_{2}$可合成液体燃料$CH_{3}OH$,反应中 CO 和$H_{2}$的分子数之比为 $ 1:2 $
。(4)$CO_{2}$是一种宝贵的资源,科学家发现了一种固定和利用$CO_{2}$的方法:在高温、高压下,用$CO_{2}$和$NH_{3}$合成尿素$[CO(NH_{2})_{2}]$,同时生成水。该反应的化学方程式为
$ {CO_{2} + 2NH_{3}\xlongequal{高温、高压}CO(NH_{2})_{2} + H_{2}O} $
。(5)工业上以食盐(NaCl)和水为反应物,通过电解制取氯气$(Cl_{2})$,同时得到烧碱(NaOH)和一种最轻的气体,该反应的化学方程式为
$ {2NaCl + 2H_{2}O\xlongequal{通电}Cl_{2}\uparrow + 2NaOH + H_{2}\uparrow} $
。
答案:
(1) $ {4NH_{3} + 3O_{2}\xlongequal{点燃}2N_{2} + 6H_{2}O} $
(2) +4 价
$ {FeTiO_{3} + 3H_{2}SO_{4}(浓)\xlongequal{\triangle}Ti(SO_{4})_{2} + FeSO_{4} + 3H_{2}O} $
(3) $ {CH_{4} + CO_{2}\xlongequal{一定条件}2CO + 2H_{2}} $ $ 1:2 $
(4) $ {CO_{2} + 2NH_{3}\xlongequal{高温、高压}CO(NH_{2})_{2} + H_{2}O} $
(5) $ {2NaCl + 2H_{2}O\xlongequal{通电}Cl_{2}\uparrow + 2NaOH + H_{2}\uparrow} $
点拨:
(1)氨气($ {NH_{3}} $)完全燃烧,即与氧气反应,其中一种生成物是空气中含量最多的物质即为氮气,另一种生成物是生活中最常见的液体即为水。
(2)根据题文信息,先用热浓硫酸处理钛铁矿(主要成分为 $ {FeTiO_{3}} $),反应中元素化合价不变,得到硫酸钛[$ {Ti(SO_{4})_{2}} $]、硫酸亚铁和一种氧化物,得出铁元素为 +2 价,一种氧化物是水,化合物中各元素的化合价代数和为 0,氧元素为 -2 价,所以 $ {FeTiO_{3}} $ 中钛元素的化合价为 +4 价。
(3)一定条件下 $ {CH_{4}} $ 与 $ {CO_{2}} $ 反应生成 $ {CO} $ 和 $ {H_{2}} $,根据化学方程式得出反应中 $ {CO} $ 和 $ {H_{2}} $ 的分子数之比为 $ 1:2 $。
(4)在高温、高压下,用 $ {CO_{2}} $ 和 $ {NH_{3}} $ 合成尿素[$ {CO(NH_{2})_{2}} $],同时生成水。
(5)工业上以食盐($ {NaCl} $)和水为反应物,通过电解制取氯气($ {Cl_{2}} $),同时得到烧碱($ {NaOH} $)和一种最轻的气体,该气体为氢气。
(1) $ {4NH_{3} + 3O_{2}\xlongequal{点燃}2N_{2} + 6H_{2}O} $
(2) +4 价
$ {FeTiO_{3} + 3H_{2}SO_{4}(浓)\xlongequal{\triangle}Ti(SO_{4})_{2} + FeSO_{4} + 3H_{2}O} $
(3) $ {CH_{4} + CO_{2}\xlongequal{一定条件}2CO + 2H_{2}} $ $ 1:2 $
(4) $ {CO_{2} + 2NH_{3}\xlongequal{高温、高压}CO(NH_{2})_{2} + H_{2}O} $
(5) $ {2NaCl + 2H_{2}O\xlongequal{通电}Cl_{2}\uparrow + 2NaOH + H_{2}\uparrow} $
点拨:
(1)氨气($ {NH_{3}} $)完全燃烧,即与氧气反应,其中一种生成物是空气中含量最多的物质即为氮气,另一种生成物是生活中最常见的液体即为水。
(2)根据题文信息,先用热浓硫酸处理钛铁矿(主要成分为 $ {FeTiO_{3}} $),反应中元素化合价不变,得到硫酸钛[$ {Ti(SO_{4})_{2}} $]、硫酸亚铁和一种氧化物,得出铁元素为 +2 价,一种氧化物是水,化合物中各元素的化合价代数和为 0,氧元素为 -2 价,所以 $ {FeTiO_{3}} $ 中钛元素的化合价为 +4 价。
(3)一定条件下 $ {CH_{4}} $ 与 $ {CO_{2}} $ 反应生成 $ {CO} $ 和 $ {H_{2}} $,根据化学方程式得出反应中 $ {CO} $ 和 $ {H_{2}} $ 的分子数之比为 $ 1:2 $。
(4)在高温、高压下,用 $ {CO_{2}} $ 和 $ {NH_{3}} $ 合成尿素[$ {CO(NH_{2})_{2}} $],同时生成水。
(5)工业上以食盐($ {NaCl} $)和水为反应物,通过电解制取氯气($ {Cl_{2}} $),同时得到烧碱($ {NaOH} $)和一种最轻的气体,该气体为氢气。
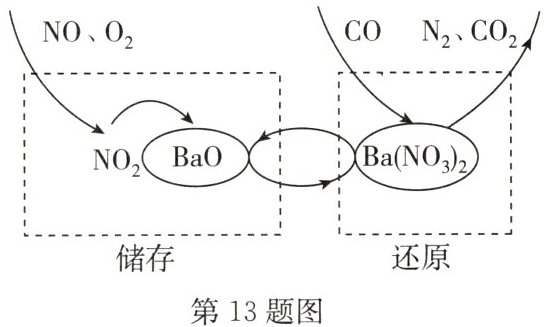
13. C NSR 技术通过 BaO 和$Ba(NO_{3})_{2}$的相互转化实现$NO_{x}$(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的$NO_{x}$排放。其工作原理如图所示。
(1)还原时,还原尾气可以是 CO、$H_{2}$等,存在如下反应:
$5CO+Ba(NO_{3})_{2}=N_{2}+X+5CO_{2}$
①反应中,碳元素的化合价 (填“升高”或“降低”)。
②X 的化学式是 。
(2)储存时,部分 NO 发生反应的化学方程式为 ;吸收$NO_{x}$(如 NO、$NO_{2}$)的物质是 。
(3)NO 气体通过 NSR 技术转化为$N_{2}$的总反应的化学方程式是 。
(1)还原时,还原尾气可以是 CO、$H_{2}$等,存在如下反应:
$5CO+Ba(NO_{3})_{2}=N_{2}+X+5CO_{2}$
①反应中,碳元素的化合价 (填“升高”或“降低”)。
②X 的化学式是 。
(2)储存时,部分 NO 发生反应的化学方程式为 ;吸收$NO_{x}$(如 NO、$NO_{2}$)的物质是 。
(3)NO 气体通过 NSR 技术转化为$N_{2}$的总反应的化学方程式是 。

答案:
(1)①升高 ② $ {BaO} $
(2) $ {2NO + O_{2}\xlongequal{}2NO_{2}} $ $ {BaO} $
(3) $ {2NO + O_{2} + 4CO\xlongequal{}N_{2} + 4CO_{2}} $
点拨:
(1)①反应前一氧化碳中碳的化合价是 +2 价,反应后二氧化碳中碳的化合价是 +4 价,所以反应中碳元素的化合价升高。②根据质量守恒定律,化学反应前后原子的种类和数目不变。反应前碳原子、氧原子、钡原子、氮原子的个数分别是 5、11、1、2;反应后已知碳原子、氧原子、钡原子、氮原子的个数分别是 5、10、0、2;所以 X 中有 1 个钡原子和 1 个氧原子,则 X 的化学式为 $ {BaO} $。
(2)根据图中信息可知,储存时,部分一氧化氮和氧气反应生成了二氧化氮,根据“NSR 技术通过 $ {BaO} $ 和 $ {Ba(NO_{3})_{2}} $ 的相互转化实现 $ {NO_{x}} $(氮氧化物)的储存和还原”,再结合图中信息可知,吸收 $ {NO_{x}} $(如 $ {NO} $、$ {NO_{2}} $)的物质是 $ {BaO} $。
(3)储存时,部分一氧化氮和氧气反应生成了二氧化氮,氧化钡吸收二氧化氮、一氧化氮生成 $ {Ba(NO_{3})_{2}} $;还原时,还原尾气可以是 $ {CO} $、$ {H_{2}} $ 等,存在如下反应: $ {5CO + Ba(NO_{3})_{2}\xlongequal{}N_{2} + BaO + 5CO_{2}} $,因此 $ {NO} $ 气体通过 NSR 技术转化为 $ {N_{2}} $ 的总反应的化学方程式为 $ {2NO + O_{2} + 4CO\xlongequal{}N_{2} + 4CO_{2}} $。
(1)①升高 ② $ {BaO} $
(2) $ {2NO + O_{2}\xlongequal{}2NO_{2}} $ $ {BaO} $
(3) $ {2NO + O_{2} + 4CO\xlongequal{}N_{2} + 4CO_{2}} $
点拨:
(1)①反应前一氧化碳中碳的化合价是 +2 价,反应后二氧化碳中碳的化合价是 +4 价,所以反应中碳元素的化合价升高。②根据质量守恒定律,化学反应前后原子的种类和数目不变。反应前碳原子、氧原子、钡原子、氮原子的个数分别是 5、11、1、2;反应后已知碳原子、氧原子、钡原子、氮原子的个数分别是 5、10、0、2;所以 X 中有 1 个钡原子和 1 个氧原子,则 X 的化学式为 $ {BaO} $。
(2)根据图中信息可知,储存时,部分一氧化氮和氧气反应生成了二氧化氮,根据“NSR 技术通过 $ {BaO} $ 和 $ {Ba(NO_{3})_{2}} $ 的相互转化实现 $ {NO_{x}} $(氮氧化物)的储存和还原”,再结合图中信息可知,吸收 $ {NO_{x}} $(如 $ {NO} $、$ {NO_{2}} $)的物质是 $ {BaO} $。
(3)储存时,部分一氧化氮和氧气反应生成了二氧化氮,氧化钡吸收二氧化氮、一氧化氮生成 $ {Ba(NO_{3})_{2}} $;还原时,还原尾气可以是 $ {CO} $、$ {H_{2}} $ 等,存在如下反应: $ {5CO + Ba(NO_{3})_{2}\xlongequal{}N_{2} + BaO + 5CO_{2}} $,因此 $ {NO} $ 气体通过 NSR 技术转化为 $ {N_{2}} $ 的总反应的化学方程式为 $ {2NO + O_{2} + 4CO\xlongequal{}N_{2} + 4CO_{2}} $。
查看更多完整答案,请扫码查看


