第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
8. B (2024·四川成都)空气中含有多少氧气呢? 学习小组开展“测定空气里氧气含量”的探究活动。
资料:1.红磷的着火点是 240℃,白磷的着火点是 40℃。
2.相同的温度和体积下,气体压强与分子数成正比。
3.相同的温度和压强下,气体体积与分子数成正比。
【史料研究】
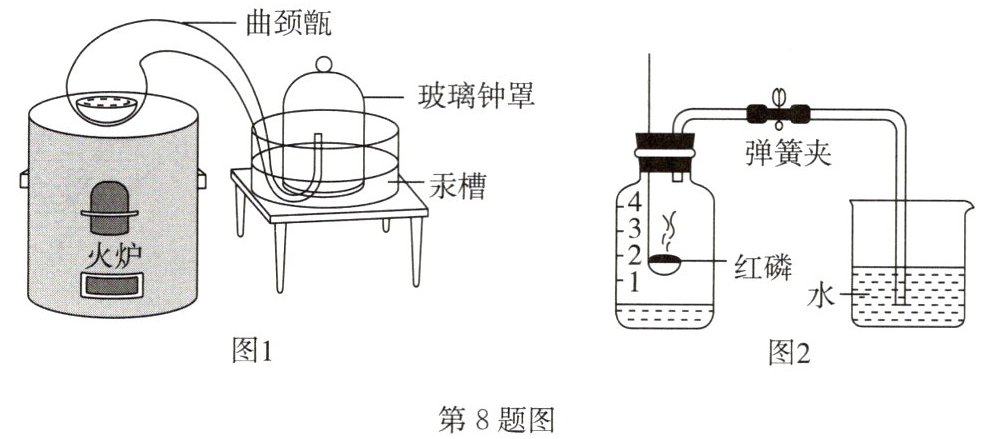
二百多年前,化学家拉瓦锡利用汞能和氧气发生反应的原理,采用图 1 装置测出氧气约占空气体积的 1/5。
(1)加热时,曲颈甑内液态汞表面产生红色粉末,玻璃钟罩内的现象是
【设计与实验】
设计并利用图 2 装置测空气里氧气含量。
(2)主要步骤如下,正确的顺序为
①弹簧夹夹紧皮管;
②红磷熄灭并冷却后,打开弹簧夹;
③点燃红磷后立即伸入瓶中并塞紧塞子;
④在集气瓶中加入少量水,将水面上方空间分成 5 等份
(3)实验结束,集气瓶中剩余气体的主要成分是
【优化与实验】
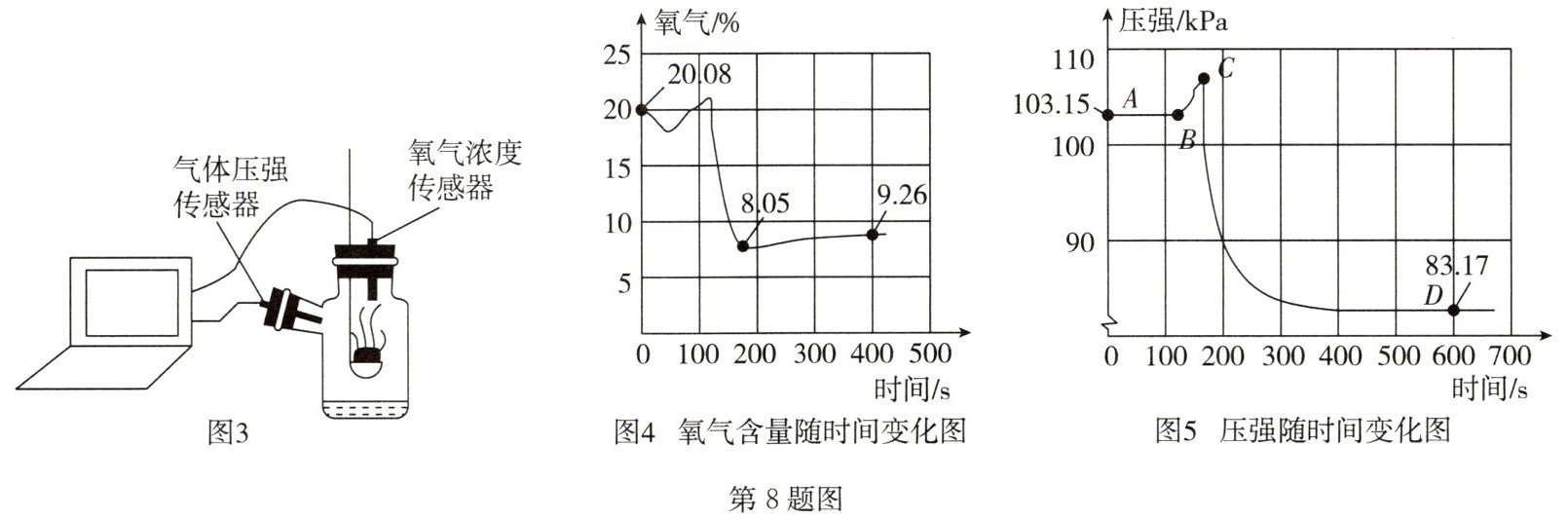
同学们利用图 2 装置多次实验,水面均未上升到刻度“1”。经讨论后,分别取足量红磷、白磷采用图 3 装置进行实验,记录并处理数据分别如图 4、图 5。
(4)图 4 中氧气含量从 8.05%上升到 9.26%,原因可能是
(5)图 5 中 BC 段压强增大,原因是
【反思与交流】
(6)图 2 实验水面未达到刻度“1”,原因是装置中的氧气未消耗完,红磷燃烧不能将氧气消耗完的主要原因是
(7)上述实验中汞、白磷和五氧化二磷有毒,对环境“不友好”,结合实验原理和试剂弊端,可选择的替代试剂有
资料:1.红磷的着火点是 240℃,白磷的着火点是 40℃。
2.相同的温度和体积下,气体压强与分子数成正比。
3.相同的温度和压强下,气体体积与分子数成正比。
【史料研究】
二百多年前,化学家拉瓦锡利用汞能和氧气发生反应的原理,采用图 1 装置测出氧气约占空气体积的 1/5。
(1)加热时,曲颈甑内液态汞表面产生红色粉末,玻璃钟罩内的现象是
汞液面上升
,产生该现象的原因是汞与氧气反应,钟罩内气体减少,气压减小
。【设计与实验】
设计并利用图 2 装置测空气里氧气含量。
(2)主要步骤如下,正确的顺序为
④①③②
(填序号)。①弹簧夹夹紧皮管;
②红磷熄灭并冷却后,打开弹簧夹;
③点燃红磷后立即伸入瓶中并塞紧塞子;
④在集气瓶中加入少量水,将水面上方空间分成 5 等份
(3)实验结束,集气瓶中剩余气体的主要成分是
氮气
。【优化与实验】
同学们利用图 2 装置多次实验,水面均未上升到刻度“1”。经讨论后,分别取足量红磷、白磷采用图 3 装置进行实验,记录并处理数据分别如图 4、图 5。
(4)图 4 中氧气含量从 8.05%上升到 9.26%,原因可能是
反应结束后,温度下降,气体逐渐混合均匀
。(5)图 5 中 BC 段压强增大,原因是
反应刚开始,温度升高对压强的影响比气体减少对压强的影响大
;计算白磷消耗的氧气占空气体积的19.37
%(精确到 0.01%)。【反思与交流】
(6)图 2 实验水面未达到刻度“1”,原因是装置中的氧气未消耗完,红磷燃烧不能将氧气消耗完的主要原因是
反应一段时间后,氧气浓度下降到一定程度,燃烧放出的热量减少,温度降低到红磷着火点以下,红磷熄灭,所以氧气消耗不完
。(7)上述实验中汞、白磷和五氧化二磷有毒,对环境“不友好”,结合实验原理和试剂弊端,可选择的替代试剂有
铜粉
(写一种)。

答案:
(1)汞液面上升 汞与氧气反应,钟罩内气体减少,气压减小
(2)④①③②
(3)氮气
(4)反应结束后,温度下降,气体逐渐混合均匀
(5)反应刚开始,温度升高对压强的影响比气体减少对压强的影响大 19.37
(6)反应一段时间后,氧气浓度下降到一定程度,燃烧放出的热量减少,温度降低到红磷着火点以下,红磷熄灭,所以氧气消耗不完
(7)铜粉
点拨:
(1)汞和氧气反应生成氧化汞固体,导致钟罩内气体减少,气压减小,则玻璃钟罩内的现象是汞液面上升;
(2)该实验的正确的顺序是检查装置气密性,在集气瓶中加入少量水,将水面上方空间分成 5 等份,用弹簧夹夹紧胶皮管,点燃红磷后立即伸入瓶中并塞紧塞子,红磷熄灭并冷却后,打开弹簧夹,则正确的顺序为④①③②。
(3)空气主要由氮气和氧气组成,红磷燃烧消耗了氧气,则实验结束,集气瓶中剩余气体的主要成分是氮气。
(4)磷燃烧消耗氧气并放出热量,而其他气体不变,氧气的含量逐渐减小,反应结束后,温度下降,气体逐渐混合均匀,导致氧气的含量增大。
(5)磷燃烧放热,温度升高,装置内压强增大,同时磷燃烧消耗氧气,装置内压强减小,但反应刚开始,温度升高对压强的影响比气体减少对压强的影响大,所以图 5 中 BC 段压强增大;磷消耗的氧气占空气体积的 $ (103.15 \text{kPa} - 83.17 \text{kPa}) / 103.15 \text{kPa} × 100\% \approx 19.37\% $;
(6)红磷燃烧放热,但反应一段时间后,氧气浓度下降到一定程度,燃烧放出的热量减少,温度降低到红磷着火点以下,红磷熄灭,导致不能将氧气消耗完;
(7)铜粉在空气中加热生成氧化铜固体,不会造成空气污染,可选择的替代试剂有铜粉。
(1)汞液面上升 汞与氧气反应,钟罩内气体减少,气压减小
(2)④①③②
(3)氮气
(4)反应结束后,温度下降,气体逐渐混合均匀
(5)反应刚开始,温度升高对压强的影响比气体减少对压强的影响大 19.37
(6)反应一段时间后,氧气浓度下降到一定程度,燃烧放出的热量减少,温度降低到红磷着火点以下,红磷熄灭,所以氧气消耗不完
(7)铜粉
点拨:
(1)汞和氧气反应生成氧化汞固体,导致钟罩内气体减少,气压减小,则玻璃钟罩内的现象是汞液面上升;
(2)该实验的正确的顺序是检查装置气密性,在集气瓶中加入少量水,将水面上方空间分成 5 等份,用弹簧夹夹紧胶皮管,点燃红磷后立即伸入瓶中并塞紧塞子,红磷熄灭并冷却后,打开弹簧夹,则正确的顺序为④①③②。
(3)空气主要由氮气和氧气组成,红磷燃烧消耗了氧气,则实验结束,集气瓶中剩余气体的主要成分是氮气。
(4)磷燃烧消耗氧气并放出热量,而其他气体不变,氧气的含量逐渐减小,反应结束后,温度下降,气体逐渐混合均匀,导致氧气的含量增大。
(5)磷燃烧放热,温度升高,装置内压强增大,同时磷燃烧消耗氧气,装置内压强减小,但反应刚开始,温度升高对压强的影响比气体减少对压强的影响大,所以图 5 中 BC 段压强增大;磷消耗的氧气占空气体积的 $ (103.15 \text{kPa} - 83.17 \text{kPa}) / 103.15 \text{kPa} × 100\% \approx 19.37\% $;
(6)红磷燃烧放热,但反应一段时间后,氧气浓度下降到一定程度,燃烧放出的热量减少,温度降低到红磷着火点以下,红磷熄灭,导致不能将氧气消耗完;
(7)铜粉在空气中加热生成氧化铜固体,不会造成空气污染,可选择的替代试剂有铜粉。
查看更多完整答案,请扫码查看


