2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
1.(2024河北邯郸期中)在一定温度下,将2 mol A气体和2 mol B气体充入体积为2 L的恒容密闭容器中,发生反应:${3A({g}) + B({g})⇌ 4C({g}) + 2D({s})}$,2 min末该反应达到平衡状态,生成D的物质的量随时间的变化情况如图所示(已知:转化率是指已转化的反应物的物质的量与其初始的物质的量之比)。下列判断正确的是 (
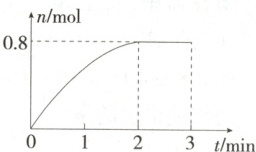
A.2 min末正、逆反应速率均为0
B.平衡时体系压强与开始时体系压强之比为$1:1$
C.反应过程中A和B的转化率之比为$1:1$
D.0~2 min内,用D表示的平均反应速率为$0.2\ {mol· L^{-1}· min^{-1}}$
B
)
A.2 min末正、逆反应速率均为0
B.平衡时体系压强与开始时体系压强之比为$1:1$
C.反应过程中A和B的转化率之比为$1:1$
D.0~2 min内,用D表示的平均反应速率为$0.2\ {mol· L^{-1}· min^{-1}}$
答案:
1.B 由题图可知,2 min 后 D 的物质的量为 0.8 mol 且不再改变,反应达到平衡状态。可列三段式:
$3A(g)+B(g)\rightleftharpoons 4C(g)+2D(s)$
起始/mol 2 2 0 0
转化/mol 1.2 0.4 1.6 0.8
平衡/mol 0.8 1.6 1.6 0.8
2 min 末正、逆反应速率相等,但反应仍在进行,故反应速率不为 0,A 错误;平衡时气体总物质的量为 0.8 mol+1.6 mol+1.6 mol = 4 mol,气体总物质的量与起始相同,故平衡时体系的压强与开始时体系的压强之比为 1:1,B 正确;由分析可知 A 的转化率为$\frac{1.2}{2} × 100\% = 60\%,$B 的转化率为$\frac{0.4}{2} × 100\% = 20\%,$A 和 B 的转化率之比为 3:1,C 错误;D 为固体,不用其单位时间内浓度的变化量来表示反应速率,D 错误。
$3A(g)+B(g)\rightleftharpoons 4C(g)+2D(s)$
起始/mol 2 2 0 0
转化/mol 1.2 0.4 1.6 0.8
平衡/mol 0.8 1.6 1.6 0.8
2 min 末正、逆反应速率相等,但反应仍在进行,故反应速率不为 0,A 错误;平衡时气体总物质的量为 0.8 mol+1.6 mol+1.6 mol = 4 mol,气体总物质的量与起始相同,故平衡时体系的压强与开始时体系的压强之比为 1:1,B 正确;由分析可知 A 的转化率为$\frac{1.2}{2} × 100\% = 60\%,$B 的转化率为$\frac{0.4}{2} × 100\% = 20\%,$A 和 B 的转化率之比为 3:1,C 错误;D 为固体,不用其单位时间内浓度的变化量来表示反应速率,D 错误。
2.(2025浙江杭州阶段测试)往一定容积的反应容器中充入2 mol NO和1 mol ${O_{2}}$,发生化学反应${2NO({g}) + O_{2}({g})⇌ 2NO_{2}({g})}$,在其他条件相同时,测得实验数据如下表:
| 压强/$(10^{5}\ {Pa})$ | 温度/${^{\circ}C}$ | NO达到所列转化率需要的时间/s |
| :--------------------- | :-------------------- | :--------------------------- |
| | | 50% 90% 98% |
| 1.0 | 30 | 12 250 2830 |
| | 90 | 25 510 5760 |
| 8.0 | 30 | 0.2 3.9 36 |
| | 90 | 0.6 7.9 74 |
分析表中数据,下列说法正确的是 (
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在$1.0× 10^{5}\ {Pa}$、$90\ {^{\circ}C}$条件下,当转化率为98%时反应已达平衡状态
D.若反应速率以$v=\Delta n/\Delta t$表示,在$8.0× 10^{5}\ {Pa}$、$30\ {^{\circ}C}$条件下,转化率0~50%时段NO的反应速率为5 mol/s
| 压强/$(10^{5}\ {Pa})$ | 温度/${^{\circ}C}$ | NO达到所列转化率需要的时间/s |
| :--------------------- | :-------------------- | :--------------------------- |
| | | 50% 90% 98% |
| 1.0 | 30 | 12 250 2830 |
| | 90 | 25 510 5760 |
| 8.0 | 30 | 0.2 3.9 36 |
| | 90 | 0.6 7.9 74 |
分析表中数据,下列说法正确的是 (
D
)A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在$1.0× 10^{5}\ {Pa}$、$90\ {^{\circ}C}$条件下,当转化率为98%时反应已达平衡状态
D.若反应速率以$v=\Delta n/\Delta t$表示,在$8.0× 10^{5}\ {Pa}$、$30\ {^{\circ}C}$条件下,转化率0~50%时段NO的反应速率为5 mol/s
答案:
2.D 根据题表信息可知,当压强相同时,升高温度,NO 达到相同转化率需要的时间更长,A 项错误;当温度相同时,增大压强,NO 达到相同转化率需要的时间缩短,故增大压强,化学反应速率加快,B 项错误;根据题表信息,无法判断此时反应是否已经达到平衡状态,C 项错误;在$ 8.0 × 10^{5} Pa、$30℃ 条件下,NO 转化率达到 50\% 所用时间为 0.2 s,若反应速率以$ v = \Delta n/\Delta t $表示,NO 的反应速率为$\frac{2 mol × 50\%}{0.2 s} = 5 mol/s,$D 项正确。
3.(2025江苏徐州期中)化学反应速率和限度与生产、生活密切相关。
Ⅰ. 某同学探究外界条件对${H_{2}O_{2}}$分解速率的影响。
| 实验序号 | ${H_{2}O_{2}}$溶液 | | 温度 | 催化剂(粉末) | 收集112 mL ${O_{2}}$所需时间/s |
| :------- | :------------------- | :--- | :--- | :------------- | :------------------------------- |
| | 浓度/$( {mol· L^{-1}} )$ | $V/{mL}$ | | | |
| 1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
| 2 | 0.4 | 20 | $50\ {^{\circ}C}$ | 无 | 296 |
| 3 | 0.4 | 20 | 室温 | 0.5 g ${CuSO_{4}}$ | 45 |
| 4 | 0.4 | 20 | 室温 | 0.5 g ${FeCl_{3}}$ | 100 |
| 5 | 0.2 | $m$ | 室温 | 0.5 g ${CuSO_{4}}$ | $>45$ |
(1)实验1、2的目的是探究
(2)对比实验3、4,能推测出${Cu^{2+}}$对${H_{2}O_{2}}$分解的催化效果比${Fe^{3+}}$更好吗?
(3)若实验3、5是探究${H_{2}O_{2}}$浓度对${H_{2}O_{2}}$分解速率的影响。$m$为10,则还应添加的试剂及用量为
Ⅱ. ${NO_{2}}$(红棕色)和${N_{2}O_{4}}$(无色)之间可发生反应:${N_{2}O_{4}({g})⇌ 2NO_{2}({g})}$。在一定温度下,将0.08 mol ${N_{2}O_{4}}$气体充入容积为2 L的密闭容器中,容器中$c({NO_{2}})$随时间变化的曲线如图所示。
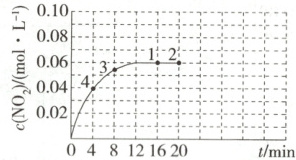
(4)1~4四个点中,$v_{ 正}=v_{ 逆}$的点有
(5)反应进行到16 min时,${N_{2}O_{4}}$的转化率是
(6)下列选项中可以说明该反应达到平衡状态的是
A. $c({N_{2}O_{4}})$不再改变
B. $v_{ 正}({N_{2}O_{4}})=2v_{ 逆}({NO_{2}})$
C. 容器内气体的颜色不再变化
D. 混合气体的平均相对分子质量不再变化
E. 混合气体的密度不再变化
认识到化学反应限度的存在,就可以通过控制反应的条件,使化学反应朝着社会发展需要的方向进行。
Ⅰ. 某同学探究外界条件对${H_{2}O_{2}}$分解速率的影响。
| 实验序号 | ${H_{2}O_{2}}$溶液 | | 温度 | 催化剂(粉末) | 收集112 mL ${O_{2}}$所需时间/s |
| :------- | :------------------- | :--- | :--- | :------------- | :------------------------------- |
| | 浓度/$( {mol· L^{-1}} )$ | $V/{mL}$ | | | |
| 1 | 0.4 | 20 | 室温 | 无 | 几乎无气体产生 |
| 2 | 0.4 | 20 | $50\ {^{\circ}C}$ | 无 | 296 |
| 3 | 0.4 | 20 | 室温 | 0.5 g ${CuSO_{4}}$ | 45 |
| 4 | 0.4 | 20 | 室温 | 0.5 g ${FeCl_{3}}$ | 100 |
| 5 | 0.2 | $m$ | 室温 | 0.5 g ${CuSO_{4}}$ | $>45$ |
(1)实验1、2的目的是探究
温度
对${H_{2}O_{2}}$分解速率的影响。(2)对比实验3、4,能推测出${Cu^{2+}}$对${H_{2}O_{2}}$分解的催化效果比${Fe^{3+}}$更好吗?
不能
(填“能”或“不能”),请说明理由:所用催化剂的阴离子不同,对实验可能产生干扰
。(3)若实验3、5是探究${H_{2}O_{2}}$浓度对${H_{2}O_{2}}$分解速率的影响。$m$为10,则还应添加的试剂及用量为
蒸馏水、10 mL
(混合后溶液体积变化忽略不计)。Ⅱ. ${NO_{2}}$(红棕色)和${N_{2}O_{4}}$(无色)之间可发生反应:${N_{2}O_{4}({g})⇌ 2NO_{2}({g})}$。在一定温度下,将0.08 mol ${N_{2}O_{4}}$气体充入容积为2 L的密闭容器中,容器中$c({NO_{2}})$随时间变化的曲线如图所示。

(4)1~4四个点中,$v_{ 正}=v_{ 逆}$的点有
1、2
(填数字)。(5)反应进行到16 min时,${N_{2}O_{4}}$的转化率是
75%
。(6)下列选项中可以说明该反应达到平衡状态的是
ACD
(填字母)。A. $c({N_{2}O_{4}})$不再改变
B. $v_{ 正}({N_{2}O_{4}})=2v_{ 逆}({NO_{2}})$
C. 容器内气体的颜色不再变化
D. 混合气体的平均相对分子质量不再变化
E. 混合气体的密度不再变化
认识到化学反应限度的存在,就可以通过控制反应的条件,使化学反应朝着社会发展需要的方向进行。
答案:
3.答案
(1)温度
(2)不能 所用催化剂的阴离子不同,对实验可能产生干扰
(3)蒸馏水、10 mL
(4)1、2
(5)75\%
(6)ACD
解析
(1)实验 1、2 中温度不同,其他条件均相同,故实验 1、2 的目的是探究温度对$ H_{2}O_{2} $分解速率的影响。
(2)实验 3、4 中催化剂不同,其他条件均相同,实验 3 中加入$ 0.5 g CuSO_{4} $粉末、实验 4 中加入$ 0.5 g FeCl_{3} $粉末,两者不仅阳离子$(Cu^{2 + } $和$ Fe^{3 + })$不同,阴离子$(SO_{4}^{2 - } $和$ Cl^{-})$也不同,故根据实验 3、4 不能推测$ Cu^{2 + } $对$ H_{2}O_{2} $分解的催化效果比$ Fe^{3 + } $更好。
(3)实验 3、5 是探究$ H_{2}O_{2} $浓度对$ H_{2}O_{2} $分解速率的影响,故实验 3、5 中的变量只有$ H_{2}O_{2} $溶液的浓度,实验 5 中取用$ 10 mL 0.2 mol · L^{-1} H_{2}O_{2} $溶液,要使溶液总体积不变,还应添加 10 mL 蒸馏水。
(4)1、2 点$ NO_{2} $的物质的量浓度不再变化,达到平衡状态,$v_{正} = v_{逆}。$
(5)反应进行到 16 min 时,$\Delta c(NO_{2}) = 0.06 mol · L^{-1},$则$ \Delta c(N_{2}O_{4}) = 0.03 mol · L^{-1},$$N_{2}O_{4} $的转化率为$\frac{0.03 mol · L^{-1}}{0.04 mol · L^{-1}} × 100\% = 75\%。$
(6)可逆反应达到平衡状态时各物质的物质的量浓度保持不变,$c(N_{2}O_{4}) $不再改变说明反应达到平衡状态,A 符合题意;$v_{正}(N_{2}O_{4}) = 2v_{逆}(NO_{2}) $时正、逆反应速率不相等,反应没有达到平衡状态,B 不符合题意;$NO_{2} $为红棕色气体,$N_{2}O_{4} $为无色气体,容器内气体颜色不再变化,说明$ NO_{2} $的物质的量浓度不再变化,反应达到平衡状态,C 符合题意;该反应反应前后气体物质的量不相等,建立平衡的过程中混合气体总质量始终不变,混合气体的平均相对分子质量是变量,故混合气体的平均相对分子质量不再变化说明反应达到平衡状态,D 符合题意;建立平衡的过程中混合气体总质量始终不变,该容器为恒容容器,混合气体的密度始终不变,故混合气体的密度不再变化不能说明反应达到平衡状态,E 不符合题意。
(1)温度
(2)不能 所用催化剂的阴离子不同,对实验可能产生干扰
(3)蒸馏水、10 mL
(4)1、2
(5)75\%
(6)ACD
解析
(1)实验 1、2 中温度不同,其他条件均相同,故实验 1、2 的目的是探究温度对$ H_{2}O_{2} $分解速率的影响。
(2)实验 3、4 中催化剂不同,其他条件均相同,实验 3 中加入$ 0.5 g CuSO_{4} $粉末、实验 4 中加入$ 0.5 g FeCl_{3} $粉末,两者不仅阳离子$(Cu^{2 + } $和$ Fe^{3 + })$不同,阴离子$(SO_{4}^{2 - } $和$ Cl^{-})$也不同,故根据实验 3、4 不能推测$ Cu^{2 + } $对$ H_{2}O_{2} $分解的催化效果比$ Fe^{3 + } $更好。
(3)实验 3、5 是探究$ H_{2}O_{2} $浓度对$ H_{2}O_{2} $分解速率的影响,故实验 3、5 中的变量只有$ H_{2}O_{2} $溶液的浓度,实验 5 中取用$ 10 mL 0.2 mol · L^{-1} H_{2}O_{2} $溶液,要使溶液总体积不变,还应添加 10 mL 蒸馏水。
(4)1、2 点$ NO_{2} $的物质的量浓度不再变化,达到平衡状态,$v_{正} = v_{逆}。$
(5)反应进行到 16 min 时,$\Delta c(NO_{2}) = 0.06 mol · L^{-1},$则$ \Delta c(N_{2}O_{4}) = 0.03 mol · L^{-1},$$N_{2}O_{4} $的转化率为$\frac{0.03 mol · L^{-1}}{0.04 mol · L^{-1}} × 100\% = 75\%。$
(6)可逆反应达到平衡状态时各物质的物质的量浓度保持不变,$c(N_{2}O_{4}) $不再改变说明反应达到平衡状态,A 符合题意;$v_{正}(N_{2}O_{4}) = 2v_{逆}(NO_{2}) $时正、逆反应速率不相等,反应没有达到平衡状态,B 不符合题意;$NO_{2} $为红棕色气体,$N_{2}O_{4} $为无色气体,容器内气体颜色不再变化,说明$ NO_{2} $的物质的量浓度不再变化,反应达到平衡状态,C 符合题意;该反应反应前后气体物质的量不相等,建立平衡的过程中混合气体总质量始终不变,混合气体的平均相对分子质量是变量,故混合气体的平均相对分子质量不再变化说明反应达到平衡状态,D 符合题意;建立平衡的过程中混合气体总质量始终不变,该容器为恒容容器,混合气体的密度始终不变,故混合气体的密度不再变化不能说明反应达到平衡状态,E 不符合题意。
查看更多完整答案,请扫码查看


