2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第16页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
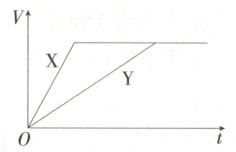
7.(2024 江苏梅村高级中学月考) 将足量且等量的形状相同的锌块分别加入等浓度、等体积的两份稀硫酸 X、Y 中, 同时向 X 中加入少量饱和 $ CuSO_4$ 溶液, 发生反应生成氢气的体积$(V)$与时间$(t)$ 的关系如图所示, X 中反应速率较快的原因是 (
A.$ Zn$ 与 $ Cu^{2+}$ 反应, 生成的 $ Cu$ 与 $ Zn$、稀硫酸形成原电池
B.加入硫酸铜溶液增大了 $c( SO_4^{2-})$
C.加入硫酸铜溶液增大了溶液体积
D.$ CuSO_4$ 作催化剂
A
)
A.$ Zn$ 与 $ Cu^{2+}$ 反应, 生成的 $ Cu$ 与 $ Zn$、稀硫酸形成原电池
B.加入硫酸铜溶液增大了 $c( SO_4^{2-})$
C.加入硫酸铜溶液增大了溶液体积
D.$ CuSO_4$ 作催化剂
答案:
7.A 由题意可知,X中反应速率更快,且最终生成H₂的体积与Y中相等,原因是Zn与Cu²⁺反应生成Cu,Cu与Zn、稀硫酸形成原电池,导致X中比Y中的反应速率快,A正确。
8.(2025 北师大附中月考) 某学习小组查阅资料知氧化性: $ MnO_4^- > Fe^{3+}$, 设计了双液原电池, 结构如图所示。盐桥中装有琼脂与饱和 $ K_2 SO_4$ 溶液, 离子在盐桥中能移动。下列说法正确的是 (
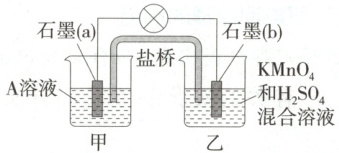
A.A 溶液为 $ Fe_2( SO_4)_3$ 溶液
B.乙烧杯中的电极反应式为 $ MnO_4^- + 8 H^+ + 5 e^- \longequal{} Mn^{2+} + 4 H_2 O$
C.外电路的电流方向为从 a 电极到 b 电极
D.电池工作时, 盐桥中的 $ SO_4^{2-}$ 移向乙烧杯
B
)
A.A 溶液为 $ Fe_2( SO_4)_3$ 溶液
B.乙烧杯中的电极反应式为 $ MnO_4^- + 8 H^+ + 5 e^- \longequal{} Mn^{2+} + 4 H_2 O$
C.外电路的电流方向为从 a 电极到 b 电极
D.电池工作时, 盐桥中的 $ SO_4^{2-}$ 移向乙烧杯
答案:
8.B 根据题意可知,氧化性:MnO₄⁻>Fe³⁺,所以乙烧杯中MnO₄⁻在b电极得电子,b电极为正极,则A溶液含有Fe²⁺,Fe²⁺在a电极失电子,a电极为负极,故A错误;乙烧杯中发生还原反应,Mn元素的化合价降低,电极反应式为MnO₄⁻+8H⁺+5e⁻=Mn²⁺+4H₂O,故B正确;a电极为负极,b电极为正极,电流由正极沿导线流向负极,即电流从b电极经过外电路流向a电极,故C错误;电池工作时,盐桥中的SO₄²⁻移向甲烧杯,故D错误。
9.(2025 河北石家庄期中) 某化学兴趣小组的几位同学在探究原电池原理的应用时, 做了如下实验。 已知: $2 Al + 2 NaOH + 6 H_2 O \longequal{} 2 Na[ Al(OH)_4] + 3 H_2 \uparrow$。
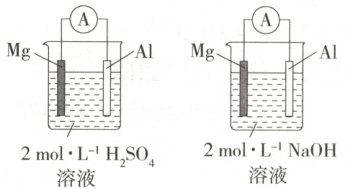
(1) 实验前, 甲同学认为原电池的负极总是较活泼的金属材料, 若根据他的判断, 两个装置中的 $ Al$ 都是
A. 利用原电池反应判断金属活动性顺序时应注意选择合适的电解质溶液
B. 镁的金属性不一定比铝的金属性强
C. 该实验说明金属活动性顺序已过时, 已没有实用价值
D. 该实验说明化学研究对象复杂, 反应受条件影响较大, 故应具体问题具体分析
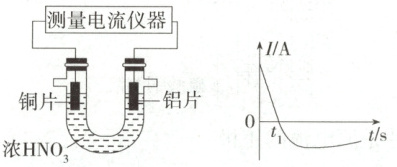
(2) 已知: 常温下, 浓硝酸能使铝表面形成致密的薄膜而钝化。乙同学利用打磨过的铜片和铝片设计了如图所示的实验装置, 并测量和绘制了原电池的电流$(I)$随时间$(t)$的变化曲线$(t_1\ s$ 后电流方向反转), 则图中 $t_1\ s$ 后, 负极材料是
在原电池中, 电子流出的一极是负极, 电子流入的一极是正极

(1) 实验前, 甲同学认为原电池的负极总是较活泼的金属材料, 若根据他的判断, 两个装置中的 $ Al$ 都是
正
极; 实际实验时发现两个装置中的电流表指针偏转方向不同, 则以下有关判断正确的是 AD
(填字母)。A. 利用原电池反应判断金属活动性顺序时应注意选择合适的电解质溶液
B. 镁的金属性不一定比铝的金属性强
C. 该实验说明金属活动性顺序已过时, 已没有实用价值
D. 该实验说明化学研究对象复杂, 反应受条件影响较大, 故应具体问题具体分析
(2) 已知: 常温下, 浓硝酸能使铝表面形成致密的薄膜而钝化。乙同学利用打磨过的铜片和铝片设计了如图所示的实验装置, 并测量和绘制了原电池的电流$(I)$随时间$(t)$的变化曲线$(t_1\ s$ 后电流方向反转), 则图中 $t_1\ s$ 后, 负极材料是
铜片
。
在原电池中, 电子流出的一极是负极, 电子流入的一极是正极
答案:
9.答案
(1)正 AD
(2)铜片
解析
(1)镁比铝活泼,甲同学认为原电池的负极总是较活泼的金属材料,所以根据他的判断,两个装置中Al都是正极。利用原电池反应判断金属活动性顺序时应注意涉及的化学反应原理,选择合适的电解质溶液,A正确;两个装置中的电流表指针偏转方向不同,是因为两个原电池涉及的化学反应不同,一个是镁和硫酸反应,一个是铝和氢氧化钠溶液反应,B错误;该实验说明应根据原电池涉及的反应来判断正、负极,而不是盲目根据金属活动性顺序来判断,C错误;该实验说明化学研究不能盲目套用经验,应具体问题具体分析,D正确。
(2)开始时,由于铝片比铜片活泼,铝片作负极,铝失电子,但常温下,铝片遇浓硝酸钝化,t₁s后铜和浓硝酸反应,所以电流方向出现反转,t₁s后铜片作负极。
(1)正 AD
(2)铜片
解析
(1)镁比铝活泼,甲同学认为原电池的负极总是较活泼的金属材料,所以根据他的判断,两个装置中Al都是正极。利用原电池反应判断金属活动性顺序时应注意涉及的化学反应原理,选择合适的电解质溶液,A正确;两个装置中的电流表指针偏转方向不同,是因为两个原电池涉及的化学反应不同,一个是镁和硫酸反应,一个是铝和氢氧化钠溶液反应,B错误;该实验说明应根据原电池涉及的反应来判断正、负极,而不是盲目根据金属活动性顺序来判断,C错误;该实验说明化学研究不能盲目套用经验,应具体问题具体分析,D正确。
(2)开始时,由于铝片比铜片活泼,铝片作负极,铝失电子,但常温下,铝片遇浓硝酸钝化,t₁s后铜和浓硝酸反应,所以电流方向出现反转,t₁s后铜片作负极。
查看更多完整答案,请扫码查看


