2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第19页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
1.(2024 四川南充期中)甲烷燃料电池以熔融碳酸盐$( K_2 CO_3、 Li_2 CO_3 ) $为电解质,该电池工作原理如图所示。
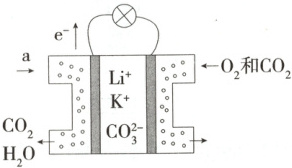
下列说法错误的是 (
A.负极的电极反应式为$ CH_4 - 8 e^- + 2 H_2 O = CO_2 + 8 H^+ $
B.标准状况下,消耗$22.4 L CH_4 $转移的电子数目为$8N_ A $($N_ A $为阿伏加德罗常数的值)
C.正极的电极反应式为$ O_2 + 2 CO_2 + 4 e^- = 2 CO_3^{2-} $
D.电池工作时,$ CO_3^{2-} $向通入 a 的一极迁移

下列说法错误的是 (
A
)A.负极的电极反应式为$ CH_4 - 8 e^- + 2 H_2 O = CO_2 + 8 H^+ $
B.标准状况下,消耗$22.4 L CH_4 $转移的电子数目为$8N_ A $($N_ A $为阿伏加德罗常数的值)
C.正极的电极反应式为$ O_2 + 2 CO_2 + 4 e^- = 2 CO_3^{2-} $
D.电池工作时,$ CO_3^{2-} $向通入 a 的一极迁移
答案:
1.A 电子流出的一极为负极,即通入a的电极为负极,a为甲烷,电极反应式为CH₄-8e⁻+4CO₃²⁻=5CO₂+2H₂O;右侧电极为正极,通入O₂和CO₂,电极反应式为O₂+2CO₂+4e⁻=2CO₃²⁻。由上述分析可知,A错误;标准状况下,22.4LCH₄的物质的量为1mol,由负极反应式CH₄-8e⁻+4CO₃²⁻=5CO₂+2H₂O可知,消耗1molCH₄转移的电子数目为8N_A,B正确;正极的电极反应式为O₂+2CO₂+4e⁻=2CO₃²⁻,C正确;电池工作时CO₃²⁻向负极迁移,D正确。
归纳总结
燃料电池电极反应式书写一般规律
反应条件 负极反应式(以CH₃OH为例) 正极反应式(以O₂为例)
酸性条件 CH₃OH+H₂O-6e⁻=CO₂+6H⁺ O₂+4H⁺+4e⁻=2H₂O
碱性条件 CH₃OH+8OH⁻-6e⁻=CO₃²⁻+6H₂O O₂+2H₂O+4e⁻=4OH⁻
熔融碳酸盐 CH₃OH+3CO₃²⁻-6e⁻=4CO₂+2H₂O O₂+2CO₂+4e⁻=2CO₃²⁻
归纳总结
燃料电池电极反应式书写一般规律
反应条件 负极反应式(以CH₃OH为例) 正极反应式(以O₂为例)
酸性条件 CH₃OH+H₂O-6e⁻=CO₂+6H⁺ O₂+4H⁺+4e⁻=2H₂O
碱性条件 CH₃OH+8OH⁻-6e⁻=CO₃²⁻+6H₂O O₂+2H₂O+4e⁻=4OH⁻
熔融碳酸盐 CH₃OH+3CO₃²⁻-6e⁻=4CO₂+2H₂O O₂+2CO₂+4e⁻=2CO₃²⁻
2.①易错题(2025 天津市实验中学月考)科学家使用$ \delta - MnO_2 $研制了一种$ MnO_2— Zn $可充电电池(如图所示)。电池工作一段时间后,$ MnO_2 $电极上检测到$ MnOOH $和少量$ ZnMn_2 O_4 $。下列叙述正确的是 (
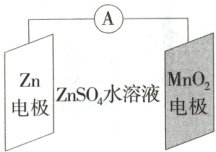
A.充电时,$ Zn^{2+} $向阳极方向迁移
B.充电时,会发生反应$ Zn + 2 MnO_2 = ZnMn_2 O_4 $
C.放电时,主要发生的正极反应为$ MnO_2 + H_2 O + e^- = MnOOH + OH^- $
D.放电时,$ Zn $电极质量减少$0.65 g $,$ MnO_2 $电极生成了$0.02 mol MnOOH $
C
)
A.充电时,$ Zn^{2+} $向阳极方向迁移
B.充电时,会发生反应$ Zn + 2 MnO_2 = ZnMn_2 O_4 $
C.放电时,主要发生的正极反应为$ MnO_2 + H_2 O + e^- = MnOOH + OH^- $
D.放电时,$ Zn $电极质量减少$0.65 g $,$ MnO_2 $电极生成了$0.02 mol MnOOH $
答案:
2.C 电池放电时MnO₂电极为正极,Zn电极为负极,充电时MnO₂电极为阳极、Zn电极为阴极。电解池中阳离子向阴极迁移,即充电时Zn²⁺向阴极方向迁移,A不正确;充电时Zn²⁺在阴极得到电子生成Zn,在阳极MnOOH和少量ZnMn₂O₄失电子生成MnO₂,B不正确;放电时MnO₂电极为正极,正极上检测到MnOOH和少量ZnMn₂O₄,正极上主要发生的电极反应是MnO₂+H₂O+e⁻=MnOOH+OH⁻,C正确;放电时,Zn电极质量减少0.65g(物质的量为0.01mol),电路中转移0.02mol电子,由正极的主要反应MnO₂+H₂O+e⁻=MnOOH+OH⁻可知,若正极的还原产物只有MnOOH,则生成MnOOH的物质的量为0.02mol,但是正极的还原产物还有ZnMn₂O₄,故生成MnOOH的物质的量小于0.02mol,D不正确。
3.(2025 河北保定阶段检测)如图是新型镁—锂双离子二次电池,下列关于该电池的说法不正确的是 (
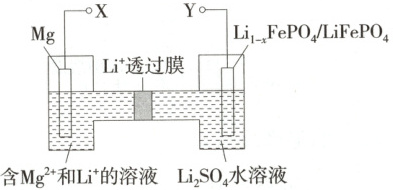
A.放电时,$ Li^+ $由左向右迁移
B.放电时,正极的电极反应式为$ Li_{1 - x} FePO_4 + x Li^+ + x e^- = LiFePO_4 $
C.放电时,镁作正极
D.充电时,外加电源的正极与 Y 相连
C
)
A.放电时,$ Li^+ $由左向右迁移
B.放电时,正极的电极反应式为$ Li_{1 - x} FePO_4 + x Li^+ + x e^- = LiFePO_4 $
C.放电时,镁作正极
D.充电时,外加电源的正极与 Y 相连
答案:
3.C 放电时,Mg电极失电子,Mg电极为负极,右侧电极为正极,C错误;放电时,阳离子移向正极,所以放电时Li⁺由左向右迁移,故A正确;放电时正极电极反应式为Li₁₋ₓFePO₄+xLi⁺+xe⁻=LiFePO₄,故B正确;充电时,外加电源的正极与二次电池的正极相连,所以充电时外加电源的正极与Y相连,故D正确。
4. ( 2023 广东高考) 负载有 Pt 和 Ag 的活性炭,可选择性去除$ Cl^- $实现废酸的纯化,其工作原理如图。下列说法正确的是 (
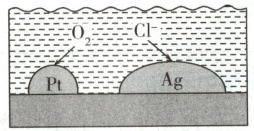
A.Ag 作原电池正极
B.电子由 Ag 经活性炭流向 Pt
C.Pt 表面发生的电极反应:$ O_2 + 2 H_2 O + 4 e^- = 4 OH^- $
D.每消耗标准状况下$11.2 L $的$ O_2 $,最多去除$1 mol Cl^- $
B
)
A.Ag 作原电池正极
B.电子由 Ag 经活性炭流向 Pt
C.Pt 表面发生的电极反应:$ O_2 + 2 H_2 O + 4 e^- = 4 OH^- $
D.每消耗标准状况下$11.2 L $的$ O_2 $,最多去除$1 mol Cl^- $
答案:
4.B O₂在Pt上得电子发生还原反应,Pt为正极,Ag为负极,A错误;电子由Ag经活性炭流向Pt,B正确;
溶液呈酸性,正极的电极反应为O₂+4H⁺+4e⁻=2H₂O,C错误;每消耗标准状况下11.2LO₂,转移电子2mol,根据负极反应Ag-e⁻+Cl⁻=AgCl可知,最多去除2molCl⁻,D错误。
溶液呈酸性,正极的电极反应为O₂+4H⁺+4e⁻=2H₂O,C错误;每消耗标准状况下11.2LO₂,转移电子2mol,根据负极反应Ag-e⁻+Cl⁻=AgCl可知,最多去除2molCl⁻,D错误。
5.(2024 河南周口太康一中月考)(1)下图是某化学兴趣小组探究化学能转变为电能的装置。
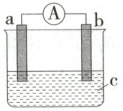
若电极 a 为 Zn、电极 b 为 Ag、c 为$ CuSO_4 $溶液,开始时 a 电极与 b 电极质量相等,当电路中转移$0.2 mol $电子时,a 电极与 b 电极质量差
为
燃料电池的能量转化率较高。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。
(2)燃料电池的工作原理是将燃料和氧化剂(如$ O_2 $)反应所放出的化学能直接转化为电能。$ CH_4 $燃料电池工作时电子流向如图所示。
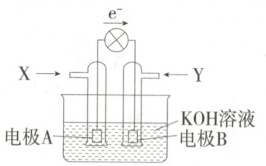
电极 A 的电极反应式为
(3)$ Li—SOCl_2 $电池可用于心脏起搏器,该电池的电极材料分别为锂和碳,电池的总反应可表示为$4 Li + 2 SOCl_2 = 4 LiCl + S + SO_2 \uparrow $。已知$ SOCl_2 $会与水反应生成有刺激性气味的气体:$ SOCl_2 + H_2 O = 2 HCl \uparrow + SO_2 \uparrow $。该电池正极的电极反应式为

若电极 a 为 Zn、电极 b 为 Ag、c 为$ CuSO_4 $溶液,开始时 a 电极与 b 电极质量相等,当电路中转移$0.2 mol $电子时,a 电极与 b 电极质量差
为
12.9
g。燃料电池的能量转化率较高。当以氢气为燃料时,产物为水;以甲烷为燃料时,产物为水和二氧化碳。
(2)燃料电池的工作原理是将燃料和氧化剂(如$ O_2 $)反应所放出的化学能直接转化为电能。$ CH_4 $燃料电池工作时电子流向如图所示。

电极 A 的电极反应式为
CH₄-8e⁻+10OH⁻=CO₃²⁻+7H₂O
,电极 A 附近 pH减小
(填“增大”“减小”或“不变”)。(3)$ Li—SOCl_2 $电池可用于心脏起搏器,该电池的电极材料分别为锂和碳,电池的总反应可表示为$4 Li + 2 SOCl_2 = 4 LiCl + S + SO_2 \uparrow $。已知$ SOCl_2 $会与水反应生成有刺激性气味的气体:$ SOCl_2 + H_2 O = 2 HCl \uparrow + SO_2 \uparrow $。该电池正极的电极反应式为
2SOCl₂+4e⁻=4Cl⁻+S+SO₂↑
;组装该电池必须在无水、无氧的条件下进行,原因是锂为活泼金属,易与水和O₂反应,SOCl₂也可与水反应,故组装该电池必须在无水、无氧条件下进行
。
答案:
5.答案
(1)12.9
(2)CH₄-8e⁻+10OH⁻=CO₃²⁻+7H₂O 减小
(3)2SOCl₂+4e⁻=4Cl⁻+S+SO₂↑ 锂为活泼金属,易与水和O₂反应,SOCl₂也可与水反应,故组装该电池必须在无水、无氧条件下进行。
解析
(1)该装置为原电池,Zn为负极,电极反应式为Zn-2e⁻=Zn²⁺,Ag为正极,电极反应式为Cu²⁺+2e⁻=Cu,当电路中转移0.2mol电子时,负极溶解0.1molZn,正极析出0.1molCu,则a电极与b电极质量差为0.1mol×64g·mol⁻¹+0.1mol×65g·mol⁻¹=12.9g。
(2)结合电子流向可知,电极A为负极,CH₄在碱性条件下发生氧化反应生成CO₃²⁻,电极反应式为CH₄-8e⁻+10OH⁻=CO₃²⁻+7H₂O,电极A附近溶液的pH减小。
(3)根据电池总反应4Li+2SOCl₂=4LiCl+S+SO₂↑可知,Li在负极发生氧化反应,SOCl₂在正极发生还原反应,正极反应式为2SOCl₂+4e⁻=4Cl⁻+S+SO₂↑;由于锂为活泼金属,易与水和O₂反应,SOCl₂也可与水反应,故组装该电池必须在无水、无氧条件下进行。
(1)12.9
(2)CH₄-8e⁻+10OH⁻=CO₃²⁻+7H₂O 减小
(3)2SOCl₂+4e⁻=4Cl⁻+S+SO₂↑ 锂为活泼金属,易与水和O₂反应,SOCl₂也可与水反应,故组装该电池必须在无水、无氧条件下进行。
解析
(1)该装置为原电池,Zn为负极,电极反应式为Zn-2e⁻=Zn²⁺,Ag为正极,电极反应式为Cu²⁺+2e⁻=Cu,当电路中转移0.2mol电子时,负极溶解0.1molZn,正极析出0.1molCu,则a电极与b电极质量差为0.1mol×64g·mol⁻¹+0.1mol×65g·mol⁻¹=12.9g。
(2)结合电子流向可知,电极A为负极,CH₄在碱性条件下发生氧化反应生成CO₃²⁻,电极反应式为CH₄-8e⁻+10OH⁻=CO₃²⁻+7H₂O,电极A附近溶液的pH减小。
(3)根据电池总反应4Li+2SOCl₂=4LiCl+S+SO₂↑可知,Li在负极发生氧化反应,SOCl₂在正极发生还原反应,正极反应式为2SOCl₂+4e⁻=4Cl⁻+S+SO₂↑;由于锂为活泼金属,易与水和O₂反应,SOCl₂也可与水反应,故组装该电池必须在无水、无氧条件下进行。
查看更多完整答案,请扫码查看


