2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第29页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
6. (2024湖北云学联盟联考)${N_{2}O_{5}}$可作硝化剂。F.Daniels等在起始压强为$p_{0}$、$25\ ^{\circ} C$体积
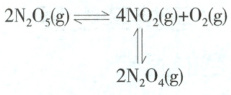
A.平衡时${O_{2}(g)}$的物质的量浓度为$\dfrac{5-b}{2V}\ \mathrm{mol·\ L^{-1}}$
B.达到平衡时体系的压强为$\dfrac{25-2a-3b}{10}p_{0}$
C.若该密闭容器中气体颜色保持不变,说明各反应已达平衡状态
D.从反应开始到达到平衡时,用${NO_{2}(g)}$表示的化学反应速率为$\dfrac{2(5-b)}{Vt}\ \mathrm{mol·\ L^{-1}· min^{-1}}$
不
变的密闭容器中,向$V\ \mathrm{L}$反应器中加入了$5\ \mathrm{mol}$的${N_{2}O_{5}}$发生如图反应,经过$t\ \mathrm{min}$后达到平衡时${N_{2}O_{4}}$为$a\ \mathrm{mol}$,${N_{2}O_{5}}$为$b\ \mathrm{mol}$。下列说法不正
确
的是 (D
)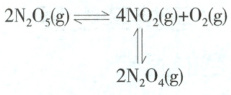
A.平衡时${O_{2}(g)}$的物质的量浓度为$\dfrac{5-b}{2V}\ \mathrm{mol·\ L^{-1}}$
B.达到平衡时体系的压强为$\dfrac{25-2a-3b}{10}p_{0}$
C.若该密闭容器中气体颜色保持不变,说明各反应已达平衡状态
D.从反应开始到达到平衡时,用${NO_{2}(g)}$表示的化学反应速率为$\dfrac{2(5-b)}{Vt}\ \mathrm{mol·\ L^{-1}· min^{-1}}$
答案:
6.D
2N₂O₅(g)⇌4NO₂(g)+O₂(g)
转化量(mol)5−b10−2b(5−b)/2
2NO₂(g)⇌N₂O₄(g)
转化量(mol)2aa
达到平衡时N₂O₄为amol,N₂O₅为bmol,平衡时NO₂的物质的量为(10−2b−2a)mol,平衡时O₂的物质的量为(5−b)/2mol。平衡时c(O₂)=(5−b)/2/VL=(5−b)/(2V)mol·L⁻¹,A正确;平衡时n(总)=[b+(10−2b−2a)+a+(5−b)/2]mol=(25−2a−3b)/2mol,根据等温等容条件下,压强之比等于物质的量之比,即p起始/p平衡=n起始/n平衡,则p₀/p平衡=5/[(25−2a−3b)/2],p平衡=(25−2a−3b)/10p₀,B正确;
NO₂为红棕色气体,当体系颜色不变时,说明NO₂的浓度不变,即各反应均已达到平衡状态,C正确;从反应开始到达到平衡时,用NO₂(g)表示的化学反应速率v(NO₂)=Δc(NO₂)/Δt=Δn(NO₂)/(VΔt)=(10−2b−2a)/(Vt)mol·L⁻¹·min⁻¹,D错误。
2N₂O₅(g)⇌4NO₂(g)+O₂(g)
转化量(mol)5−b10−2b(5−b)/2
2NO₂(g)⇌N₂O₄(g)
转化量(mol)2aa
达到平衡时N₂O₄为amol,N₂O₅为bmol,平衡时NO₂的物质的量为(10−2b−2a)mol,平衡时O₂的物质的量为(5−b)/2mol。平衡时c(O₂)=(5−b)/2/VL=(5−b)/(2V)mol·L⁻¹,A正确;平衡时n(总)=[b+(10−2b−2a)+a+(5−b)/2]mol=(25−2a−3b)/2mol,根据等温等容条件下,压强之比等于物质的量之比,即p起始/p平衡=n起始/n平衡,则p₀/p平衡=5/[(25−2a−3b)/2],p平衡=(25−2a−3b)/10p₀,B正确;
NO₂为红棕色气体,当体系颜色不变时,说明NO₂的浓度不变,即各反应均已达到平衡状态,C正确;从反应开始到达到平衡时,用NO₂(g)表示的化学反应速率v(NO₂)=Δc(NO₂)/Δt=Δn(NO₂)/(VΔt)=(10−2b−2a)/(Vt)mol·L⁻¹·min⁻¹,D错误。
7. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气制取氢气。
方法Ⅰ:氨热分解法制氢气
(1)已知该反应为可逆反应,在一定温度下,利用催化剂将${NH_{3}}$分解为${N_{2}}$和${H_{2}}$的化学方程式为$\boldsymbol{$
(2)该反应为吸热反应,说明反应物的总能量$\boldsymbol{$
(3)在一定温度和催化剂存在的条件下,向$10\ \mathrm{L}$容积固定的密闭容器中充入$2\ \mathrm{mol}\ {NH_{3}}$发生该反应,$5\ \mathrm{min}$末测得容器中$n({NH_{3}})=1.2\ \mathrm{mol}$,则在$0\sim5\ \mathrm{min}$内,用${H_{2}}$表示的反应速率为$\boldsymbol{$
(4)该反应达到化学平衡状态的标志是$\boldsymbol{$
A.${NH_{3}}$的浓度为$0$
B.${H_{2}}$的物质的量保持不变
C.正反应速率与逆反应速率相等
D.${NH_{3}}$、${N_{2}}$、${H_{2}}$的物质的量之比为$2:1:3$
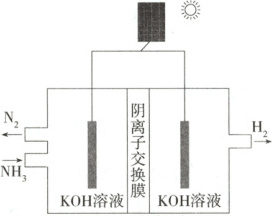
方法Ⅱ:氨电解法制氢气
(5)利用电解原理,将氨转化为高纯氢气,其装置如图所示。装置中生成$1\ \mathrm{mol}\ {H_{2}}$时,电路中通过$\boldsymbol{$
方法Ⅰ:氨热分解法制氢气
(1)已知该反应为可逆反应,在一定温度下,利用催化剂将${NH_{3}}$分解为${N_{2}}$和${H_{2}}$的化学方程式为$\boldsymbol{$
2NH₃$\xlongequal[一定温度]{催化剂}$N₂+3H₂
$}$。(2)该反应为吸热反应,说明反应物的总能量$\boldsymbol{$
小于
$}$(填“大于”“小于”或“等于”)生成物的总能量。(3)在一定温度和催化剂存在的条件下,向$10\ \mathrm{L}$容积固定的密闭容器中充入$2\ \mathrm{mol}\ {NH_{3}}$发生该反应,$5\ \mathrm{min}$末测得容器中$n({NH_{3}})=1.2\ \mathrm{mol}$,则在$0\sim5\ \mathrm{min}$内,用${H_{2}}$表示的反应速率为$\boldsymbol{$
0.024
$}\ \mathrm{mol·\ L^{-1}· min^{-1}}$。(4)该反应达到化学平衡状态的标志是$\boldsymbol{$
BC
$}$(填字母)。A.${NH_{3}}$的浓度为$0$
B.${H_{2}}$的物质的量保持不变
C.正反应速率与逆反应速率相等
D.${NH_{3}}$、${N_{2}}$、${H_{2}}$的物质的量之比为$2:1:3$
方法Ⅱ:氨电解法制氢气
(5)利用电解原理,将氨转化为高纯氢气,其装置如图所示。装置中生成$1\ \mathrm{mol}\ {H_{2}}$时,电路中通过$\boldsymbol{$
2/3
$}\ \mathrm{mol}$电子。为提高制取氢气的反应速率,可采取的方法是$\boldsymbol{$适当增大氨气的浓度(合理即可)
$}$。
答案:
7.答案
(1)2NH₃$\xlongequal[一定温度]{催化剂}$N₂+3H₂
(2)小于
(3)0.024
(4)BC
(5)2/3适当增大氨气的浓度(合理即可)
解析
(3)充入2molNH₃,发生反应,5min末测得容器中n(NH₃)=1.2mol,v(NH₃)=(2−1.2)mol/(10L×5min)=0.016mol·L⁻¹·min⁻¹,v(H₂)=3/2v(NH₃)=0.024mol·L⁻¹·min⁻¹。
(4)该反应是可逆反应,NH₃不能完全转化,则NH₃的浓度不可能为0,A错误;反应达到化学平衡状态时各物质的物质的量不再改变,则H₂的物质的量保持不变可说明达到平衡状态,B正确;正反应速率与逆反应速率相等说明反应达到平衡状态,C正确;NH₃、N₂、H₂的物质的量之比为2:1:3,不能说明反应达到平衡状态,D错误。
(5)由反应2NH₃$\xlongequal{通电}$N₂+3H₂可知,生成3molH₂时,电路中通过2mol电子,装置中生成1molH₂时,电路中通过2/3mol电子;为提高制取氢气的反应速率,可适当增大氨气的浓度。
(1)2NH₃$\xlongequal[一定温度]{催化剂}$N₂+3H₂
(2)小于
(3)0.024
(4)BC
(5)2/3适当增大氨气的浓度(合理即可)
解析
(3)充入2molNH₃,发生反应,5min末测得容器中n(NH₃)=1.2mol,v(NH₃)=(2−1.2)mol/(10L×5min)=0.016mol·L⁻¹·min⁻¹,v(H₂)=3/2v(NH₃)=0.024mol·L⁻¹·min⁻¹。
(4)该反应是可逆反应,NH₃不能完全转化,则NH₃的浓度不可能为0,A错误;反应达到化学平衡状态时各物质的物质的量不再改变,则H₂的物质的量保持不变可说明达到平衡状态,B正确;正反应速率与逆反应速率相等说明反应达到平衡状态,C正确;NH₃、N₂、H₂的物质的量之比为2:1:3,不能说明反应达到平衡状态,D错误。
(5)由反应2NH₃$\xlongequal{通电}$N₂+3H₂可知,生成3molH₂时,电路中通过2mol电子,装置中生成1molH₂时,电路中通过2/3mol电子;为提高制取氢气的反应速率,可适当增大氨气的浓度。
8. (2025北京清华大学附中统练)某小组对${Fe^{2+}}$和${Ag^{+}}$的反应进行了如下探究实验:
| | 实验Ⅰ | 实验Ⅱ |
| --- | --- | --- |
| 操作 | 向$1\ \mathrm{mL}\ 0.1\ \mathrm{mol/L}\ {FeSO_{4}}$溶液中加入$1\ \mathrm{mL}\ 0.1\ \mathrm{mol/L}\ {AgNO_{3}}$溶液 | 先向试管中加入几滴${Fe_{2}(SO_{4})_{3}}$溶液,然后重复实验Ⅰ的操作 |
| 现象 | 几分钟后,出现大量灰黑色浑浊 | 现象与实验Ⅰ相同 |
| ${Ag^{+}}$浓度变化曲线 | | |
(已知:${Ag_{2}SO_{4}}$为白色微溶物;反应过程中测得温度几乎无变化)

下列说法正确的是 (
A.实验Ⅰ只发生反应${Fe^{2+} + Ag^{+}⇌ Fe^{3+} + Ag}$,灰黑色浑浊是$Ag$
B.图中$c({Ag^{+}})$由$a\rightarrow b$急速变化的可能原因是反应放热
C.图中$c({Ag^{+}})$由$a\rightarrow b$急速变化的可能原因是生成的$Ag$起催化作用
D.图中$c({Ag^{+}})$由$a\rightarrow b$急速变化的可能原因是生成的${Fe^{3+}}$起催化作用
| | 实验Ⅰ | 实验Ⅱ |
| --- | --- | --- |
| 操作 | 向$1\ \mathrm{mL}\ 0.1\ \mathrm{mol/L}\ {FeSO_{4}}$溶液中加入$1\ \mathrm{mL}\ 0.1\ \mathrm{mol/L}\ {AgNO_{3}}$溶液 | 先向试管中加入几滴${Fe_{2}(SO_{4})_{3}}$溶液,然后重复实验Ⅰ的操作 |
| 现象 | 几分钟后,出现大量灰黑色浑浊 | 现象与实验Ⅰ相同 |
| ${Ag^{+}}$浓度变化曲线 | | |
(已知:${Ag_{2}SO_{4}}$为白色微溶物;反应过程中测得温度几乎无变化)

下列说法正确的是 (
C
)A.实验Ⅰ只发生反应${Fe^{2+} + Ag^{+}⇌ Fe^{3+} + Ag}$,灰黑色浑浊是$Ag$
B.图中$c({Ag^{+}})$由$a\rightarrow b$急速变化的可能原因是反应放热
C.图中$c({Ag^{+}})$由$a\rightarrow b$急速变化的可能原因是生成的$Ag$起催化作用
D.图中$c({Ag^{+}})$由$a\rightarrow b$急速变化的可能原因是生成的${Fe^{3+}}$起催化作用
答案:
8.C 溶液中存在Ag⁺、SO₄²⁻,故还可发生反应2Ag⁺+SO₄²⁻=Ag₂SO₄↓,Ag₂SO₄为白色微溶物,灰黑色浑浊应是Ag和Ag₂SO₄的混合物,A错误;反应过程中测得温度几乎无变化,则c(Ag⁺)由a→b急速变化的原因不可能是反应放热,B错误;实验Ⅱ中,先加入Fe₂(SO₄)₃溶液,然后重复实验Ⅰ的操作,现象与实验Ⅰ相同,结合反应Fe²⁺+Ag⁺=Fe³⁺+Ag可知,Fe³⁺没有起催化作用,应是生成的Ag起催化作用,C正确、D错误。
查看更多完整答案,请扫码查看


