2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
1. (2025天津中学期中)向绝热恒容密闭容器中通入${SO_{2}}$和${NO_{2}}$,在一定条件下发生反应${SO_{2}(g) + NO_{2}(g)⇌ SO_{3}(g) + NO(g)}$,正反应速率随时间变化的关系如图,下列说法中正确的有 (
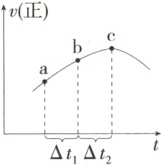
①反应在$c$点达到平衡
②${SO_{2}}$浓度:$a$点小于$c$点
③反应物的总能量低于生成物的总能量
④$\Delta t_{1}=\Delta t_{2}$,$ab$段${NO_{2}}$的消耗量小于$bc$段${NO_{2}}$的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
A.3个
B.4个
C.5个
D.6个
A
)
①反应在$c$点达到平衡
②${SO_{2}}$浓度:$a$点小于$c$点
③反应物的总能量低于生成物的总能量
④$\Delta t_{1}=\Delta t_{2}$,$ab$段${NO_{2}}$的消耗量小于$bc$段${NO_{2}}$的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
A.3个
B.4个
C.5个
D.6个
答案:
1.A c点后正反应速率还在改变,一定条件下,反应达到平衡时正、逆反应速率相等且不再改变,则反应在c点未达到平衡,①不正确;随着反应的进行,SO₂浓度越来越小,SO₂的浓度:a点大于c点,②不正确;从a点到c点正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高,对正反应速率的影响大于浓度减小对正反应速率的影响,则说明该反应为放热反应,故反应物的总能量高于生成物的总能量,③不正确;Δt₁=Δt₂,由于ab段的平均正反应速率小于bc段的平均正反应速率,所以ab段NO₂的消耗量小于bc段NO₂的消耗量,④正确;混合物颜色不再变化,表明NO₂的浓度保持不变,说明反应达到平衡状态,⑤正确;反应前后气体分子数相等,但温度不断发生改变,导致平衡前体系的压强不断发生改变,则体系压强不再变化,说明反应达到平衡状态,⑥正确;故选A。
2. (2024江苏盐城五校联考)某实验小组为探究影响${H_{2}O_{2}}$分解的因素设计表中实验,下列有关说法错误的是 (
| | 溶液 | 温度 | 时间(收集$\boldsymbol{50\ \mathrm{mL}\ {O_{2}}}$) |
| --- | --- | --- | --- |
| ① | $10\ \mathrm{mL}\ 15\%\ {H_{2}O_{2}}$溶液 | $25\ ^{\circ} C$ | $160\ \mathrm{s}$ |
| ② | $10\ \mathrm{mL}\ 30\%\ {H_{2}O_{2}}$溶液 | $25\ ^{\circ} C$ | $120\ \mathrm{s}$ |
| ③ | $10\ \mathrm{mL}\ 15\%\ {H_{2}O_{2}}$溶液 | $50\ ^{\circ} C$ | $50\ \mathrm{s}$ |
| ④ | $10\ \mathrm{mL}\ 15\%\ {H_{2}O_{2}}$溶液+$1\ \mathrm{mL}\ 5\%\ {FeCl_{3}}$溶液 | $50\ ^{\circ} C$ | $20\ \mathrm{s}$ |
A.①和②可探究浓度对${H_{2}O_{2}}$分解速率的影响
B.①和③可探究温度对${H_{2}O_{2}}$分解速率的影响
C.①和④可探究催化剂对${H_{2}O_{2}}$分解速率的影响
D.由上述实验可知,增大${H_{2}O_{2}}$浓度、升高温度都能加快${H_{2}O_{2}}$分解速率
C
)| | 溶液 | 温度 | 时间(收集$\boldsymbol{50\ \mathrm{mL}\ {O_{2}}}$) |
| --- | --- | --- | --- |
| ① | $10\ \mathrm{mL}\ 15\%\ {H_{2}O_{2}}$溶液 | $25\ ^{\circ} C$ | $160\ \mathrm{s}$ |
| ② | $10\ \mathrm{mL}\ 30\%\ {H_{2}O_{2}}$溶液 | $25\ ^{\circ} C$ | $120\ \mathrm{s}$ |
| ③ | $10\ \mathrm{mL}\ 15\%\ {H_{2}O_{2}}$溶液 | $50\ ^{\circ} C$ | $50\ \mathrm{s}$ |
| ④ | $10\ \mathrm{mL}\ 15\%\ {H_{2}O_{2}}$溶液+$1\ \mathrm{mL}\ 5\%\ {FeCl_{3}}$溶液 | $50\ ^{\circ} C$ | $20\ \mathrm{s}$ |
A.①和②可探究浓度对${H_{2}O_{2}}$分解速率的影响
B.①和③可探究温度对${H_{2}O_{2}}$分解速率的影响
C.①和④可探究催化剂对${H_{2}O_{2}}$分解速率的影响
D.由上述实验可知,增大${H_{2}O_{2}}$浓度、升高温度都能加快${H_{2}O_{2}}$分解速率
答案:
2.C 实验①和②,变量为H₂O₂浓度,可探究浓度对H₂O₂分解速率的影响,A正确;实验①和③,变量为温度,可探究温度对H₂O₂分解速率的影响,B正确;实验①和④相比,实验④中加入的FeCl₃溶液导致两组中H₂O₂的浓度略有差别,且两组温度不同,不能探究催化剂对H₂O₂分解速率的影响,C错误;通过实验数据和以上分析可知,增大浓度、升高温度都能加快H₂O₂分解速率,D正确。
3. (2025山东省实验中学阶段测试)已知:${N_{2}(g) + 3H_{2}(g)⇌ 2NH_{3}(g)}\ \ \Delta H=-92.4\ \mathrm{kJ·\ mol^{-1}}$。下列有关说法不正确的是 (
A.绝热条件下当体系温度不变时,说明该反应达到平衡状态
B.在恒容密闭容器内,反应达平衡状态后,通入$Ar$,压强增大,但$v$(正)和$v$(逆)都不变
C.断裂$6\ \mathrm{mol}\ N-H$键的同时,形成$3\ \mathrm{mol}\ H-H$键,说明该反应达到平衡状态
D.在容器中充入$1\ \mathrm{mol}\ {N_{2}}$和$3\ \mathrm{mol}\ {H_{2}}$,一定条件下充分反应,放出的热量少于$92.4\ \mathrm{kJ}$
C
)A.绝热条件下当体系温度不变时,说明该反应达到平衡状态
B.在恒容密闭容器内,反应达平衡状态后,通入$Ar$,压强增大,但$v$(正)和$v$(逆)都不变
C.断裂$6\ \mathrm{mol}\ N-H$键的同时,形成$3\ \mathrm{mol}\ H-H$键,说明该反应达到平衡状态
D.在容器中充入$1\ \mathrm{mol}\ {N_{2}}$和$3\ \mathrm{mol}\ {H_{2}}$,一定条件下充分反应,放出的热量少于$92.4\ \mathrm{kJ}$
答案:
3.C 该反应为放热反应,绝热条件下随反应进行,体系温度不断变化,当体系温度不变时,说明反应已达到平衡状态,A正确;恒容密闭容器中达到平衡后,通入Ar,虽然体系压强增大,但是反应物和生成物的浓度都不变,正、逆反应速率不变,B正确;断裂6molN—H键的同时形成3molH—H键,不能说明正、逆反应速率相等,该反应不一定达到平衡状态,C错误;该反应为可逆反应,充入1molN₂和3molH₂,无法全部转化为NH₃,故放出的热量少于92.4kJ,D正确。
易错分析
通过断键和成键数目来判断反应是否达到平衡状态时,一定要注意反应方向,若表示相同反应方向,则无法说明正、逆反应速率相等。
易错分析
通过断键和成键数目来判断反应是否达到平衡状态时,一定要注意反应方向,若表示相同反应方向,则无法说明正、逆反应速率相等。
4. (2025河北保定阶段检测)在两个恒温恒容的密闭容器中进行下列两个可逆反应:$2X(g)⇌ Y(g) + Z(s)$ 甲,$A(s) + 2B(g)⇌ C(g) + D(g)$ 乙。当满足下列条件时:①混合气体的密度不再发生变化;②反应容器中生成物的百分含量不再发生变化;③反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比;④混合气体的压强不再发生变化;⑤混合气体的总物质的量不再发生变化。能表明甲和乙都达到化学平衡状态的是 (
A.①②③
B.②③⑤
C.①②③⑤
D.①②④⑤
A
)A.①②③
B.②③⑤
C.①②③⑤
D.①②④⑤
答案:
4.A 恒温恒容密闭体系中,ρ=m/V,甲、乙反应过程中,V均一定,但是由于两个反应均有固体参与,m为变量,只有当反应达到平衡时,m才不变,气体的密度不再变化,故混合气体的密度不再变化能作为反应达平衡的标志,①符合题意;只有在反应达到平衡时,各物质的浓度才保持不变,生成物的百分含量不变,故反应容器中生成物的百分含量不再变化能作为反应达平衡的标志,②符合题意;反应物消耗表示正反应过程,生成物消耗表示逆反应过程,反应物的消耗速率与生成物的消耗速率之比等于化学计量数之比能作为反应达平衡的标志,③符合题意;恒温恒容密闭体系中,甲反应前后气体分子数改变,而乙反应前后气体分子数不变,因此进行乙反应时,气体的总物质的量保持恒定,则压强恒定,因此混合气体的压强不变不能表明乙达到平衡状态,④不符合题意;甲反应前后气体分子总数改变,而乙反应前后气体分子总数不变,甲中气体的总物质的量在变化,乙中气体的总物质的量不变,混合气体的总物质的量不再发生变化不能表明乙达到平衡状态,⑤不符合题意;故选A。
易错分析
易忽视反应中有固体参加,恒温恒容密闭体系中固体参加反应对混合气体密度有影响。
易错分析
易忽视反应中有固体参加,恒温恒容密闭体系中固体参加反应对混合气体密度有影响。
5. (2025江苏苏州段考)某固体酸性氢氧燃料电池以${NaHSO_{4}}$固体为电解质传递${H^{+}}$,其基本结构如图,电池总反应为${2H_{2} + O_{2}\xlongequal{}2H_{2}O}$,下列有关说法正确的是 (
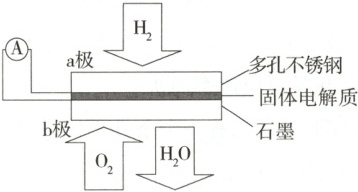
A.电子通过外电路从$b$极流向$a$极
B.每转移$0.1\ \mathrm{mol}$电子,消耗$1.12\ \mathrm{L}$的${H_{2}}$
C.$b$极反应式为${O_{2} + 2H_{2}O + 4e^{-}\xlongequal{}4OH^{-}}$
D.${H^{+}}$由$a$极通过固体电解质传递到$b$极
D
)
A.电子通过外电路从$b$极流向$a$极
B.每转移$0.1\ \mathrm{mol}$电子,消耗$1.12\ \mathrm{L}$的${H_{2}}$
C.$b$极反应式为${O_{2} + 2H_{2}O + 4e^{-}\xlongequal{}4OH^{-}}$
D.${H^{+}}$由$a$极通过固体电解质传递到$b$极
答案:
5.D 根据电池总反应2H₂+O₂=2H₂O可知,通入氢气的a极为电池的负极,通入氧气的b极为电池的正极,电子在外电路由a极流向b极,A错误;负极反应式为H₂−2e⁻=2H⁺,每转移0.1mol电子,消耗0.05mol氢气,未指明是否在标准状况下,H₂体积不一定为1.12L,B错误;b极反应式为O₂+4e⁻+4H⁺=2H₂O,C错误;原电池中,阳离子向正极移动,所以H⁺由a极通过固体电解质传递到b极,D正确。
易错分析
书写电极反应式时常见的错误:一是忽视反应类型。要牢记负极失去电子,发生氧化反应,正极得到电子,发生还原反应。二是忽视电荷守恒。三是忽视电池电解质类型。
易错分析
书写电极反应式时常见的错误:一是忽视反应类型。要牢记负极失去电子,发生氧化反应,正极得到电子,发生还原反应。二是忽视电荷守恒。三是忽视电池电解质类型。
查看更多完整答案,请扫码查看


