2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第2页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
7. (2025 江苏宿迁期中)甲、乙两个容器内进行 $A$ 生成 $B$ 的反应,甲中每分钟减少 $4 \ \mathrm{mol} \ A$,乙中每分钟减少了 $2 \ \mathrm{mol} \ A$,则两容器中的反应速率 (
A.甲快
B.乙快
C.相等
D.无法比较
D
)A.甲快
B.乙快
C.相等
D.无法比较
答案:
7.D 化学反应速率的计算公式$v=\frac{\Delta n}{\Delta t· V}$,$\Delta t$相等,甲容器中的$\Delta n$为4mol,乙容器中的$\Delta n$为2mol,但甲和乙容器的体积未知,故不能比较两容器中的反应速率,故选D。
8. (2025 江苏普通高中学业水平合格性考试调研)对于反应 $3A(g) + B(g)⇌_{2}C(g) + 2D(g)$ 在不同条件下的化学反应速率如下,其中表示反应速率最快的是 (
A.$v(A)=0.1 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{s}^{-1}$
B.$v(B)=3 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{min}^{-1}$
C.$v(C)=8 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{min}^{-1}$
D.$v(D)=4 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{min}^{-1}$
C
)A.$v(A)=0.1 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{s}^{-1}$
B.$v(B)=3 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{min}^{-1}$
C.$v(C)=8 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{min}^{-1}$
D.$v(D)=4 \ \mathrm{mol} · \mathrm{L}^{-1} · \mathrm{min}^{-1}$
答案:
8.C A项单位与其他选项单位不一致,需先统一单位,再将各物质的反应速率转化成同一物质(如A)表示的反应速率进行比较。A项,$v( A)=0.1 mol· L^{-1}· s^{-1}=0.1× 60 mol· L^{-1}· min^{-1}=6 mol· L^{-1}· min^{-1}$;B项,$v( A)=3v( B)=3× 3 mol· L^{-1}· min^{-1}=9 mol· L^{-1}· min^{-1}$;C项,$v( A)=\frac{3}{2}v( C)=\frac{3}{2}× 8 mol· L^{-1}· min^{-1}=12 mol· L^{-1}· min^{-1}$;D项,$v( A)=\frac{3}{2}v( D)=\frac{3}{2}× 4 mol· L^{-1}· min^{-1}=6 mol· L^{-1}· min^{-1}$;综上所述,C项符合题意。
一题多解
此题还可运用比值法计算,$v( A)=0.1 mol· L^{-1}· s^{-1}=6 mol· L^{-1}· min^{-1}$,统一单位后,A、B、C、D四项反应速率的数值与对应物质化学计量数的比的值分别为2、3、4、2,最大的为C项,对应的反应速率最快。
一题多解
此题还可运用比值法计算,$v( A)=0.1 mol· L^{-1}· s^{-1}=6 mol· L^{-1}· min^{-1}$,统一单位后,A、B、C、D四项反应速率的数值与对应物质化学计量数的比的值分别为2、3、4、2,最大的为C项,对应的反应速率最快。
9. (2024 江苏扬州大学附中月考)下列措施对增大反应速率有效的是 (
A.${N_{2}}$ 与 ${H_{2}}$ 合成氨气时,适当提高体系的温度
B.$Zn$ 与稀硫酸反应制取氢气时,将稀硫酸改为浓硫酸
C.${K_{2}SO_{4}}$ 溶液与 ${BaCl_{2}}$ 溶液反应时,增大压强
D.$Na$ 与水反应时,增大水的用量
A
)A.${N_{2}}$ 与 ${H_{2}}$ 合成氨气时,适当提高体系的温度
B.$Zn$ 与稀硫酸反应制取氢气时,将稀硫酸改为浓硫酸
C.${K_{2}SO_{4}}$ 溶液与 ${BaCl_{2}}$ 溶液反应时,增大压强
D.$Na$ 与水反应时,增大水的用量
答案:
9.A 升高温度可增大反应速率,合成氨气时,适当提高体系的温度可增大反应速率,A正确;Zn与浓硫酸反应生成$ SO_{2}$,得不到$ H_{2}$,B错误;该反应是在溶液中进行的化学反应,没有气体参加或生成,增大压强不能改变反应速率,C错误;Na与水反应时增加水的量不能增大反应速率,D错误。
10. (2024 福建莆田第一中学期中)我国科学家研发的新型催化剂可用于甲烷制备乙酸的反应:${2CH_{4}(g) + 2O_{2}(g)\xlongequal[\triangle]{ 催化剂} CH_{3}COOH(g) + 2H_{2}O(g)}$。在恒容密闭容器中发生上述反应,下列说法错误的是 (
A.其他条件不变,升高温度,反应速率增大
B.其他条件不变,充入稀有气体,反应速率增大
C.相同时间段内 ${CH_{4}}$、${O_{2}}$ 的反应速率相等
D.其他条件不变,再充入一定体积的 ${CH_{4}}$,能增大反应速率
B
)A.其他条件不变,升高温度,反应速率增大
B.其他条件不变,充入稀有气体,反应速率增大
C.相同时间段内 ${CH_{4}}$、${O_{2}}$ 的反应速率相等
D.其他条件不变,再充入一定体积的 ${CH_{4}}$,能增大反应速率
答案:
10.B 其他条件不变,在恒容密闭容器中充入稀有气体,虽然气体总压强增大,但反应物和生成物浓度都不变,则反应速率不变,B错误。
11. (2025 河北保定阶段练习)为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验(锌片大小相同):
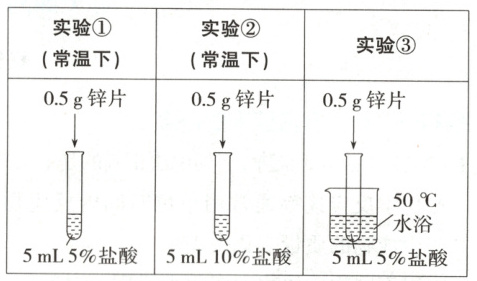
下列说法正确的是 (
A.对比实验①和②,可探究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可探究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可探究温度对反应剧烈程度的影响
D.对比实验①和②,可探究温度对反应剧烈程度的影响

下列说法正确的是 (
A
)A.对比实验①和②,可探究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可探究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可探究温度对反应剧烈程度的影响
D.对比实验①和②,可探究温度对反应剧烈程度的影响
答案:
11.A 对比实验①和②,知盐酸的浓度不同,其他条件均相同,可探究盐酸的浓度对反应剧烈程度的影响,A正确,D错误;对比实验②和③,反应温度不同,盐酸的浓度不同,不是单一变量,无法探究盐酸的浓度和温度对反应剧烈程度的影响,B、C错误。
12. (2025 江苏盐城阶段练习)一定条件下,在 $2 \ \mathrm{L}$ 的密闭容器中,$X$、$Y$、$Z$ 三种气体的量随时间变化的曲线如图所示:
(1) 从反应开始到 $10 \ \mathrm{s}$ 末,$X$ 的物质的量减少了
(2) 该反应的化学方程式为
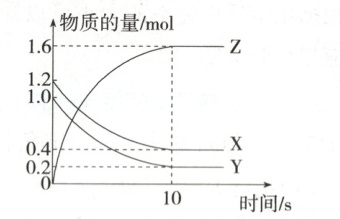
(1) 从反应开始到 $10 \ \mathrm{s}$ 末,$X$ 的物质的量减少了
0.8
$\mathrm{mol}$,$Z$ 的物质的量浓度增大了 0.8
$\mathrm{mol} · \mathrm{L}^{-1}$,用 $Z$ 表示的反应速率为 0.08
$\mathrm{mol} · \mathrm{L}^{-1} · \mathrm{s}^{-1}$。(2) 该反应的化学方程式为
X+Y⇌2Z
(用 $X$、$Y$、$Z$ 表示)。
答案:
12.答案
(1)0.8 0.8 0.08
(2)$ X+ Y\xrightleftharpoons{一定条件}2 Z$
解析
(1)根据图像可知,从反应开始到10s末,X的物质的量减少了$1.2 mol-0.4 mol=0.8 mol$,Z的物质的量浓度增大了$\frac{1.6 mol}{2 L}=0.8 mol· L^{-1}$,用Z表示的反应速率为$\frac{0.8 mol· L^{-1}}{10 s}=0.08 mol· L^{-1}· s^{-1}$。
(2)根据图像可知,从反应开始到10s末,X的物质的量减少了0.8mol,Y的物质的量减少了$1.0 mol-0.2 mol=0.8 mol$,X、Y最后都有剩余,Z的物质的量增加了1.6mol,根据各物质的物质的量变化量之比等于化学计量数之比可知,该反应的化学方程式为$ X+ Y\xrightleftharpoons{一定条件}2 Z$。
(1)0.8 0.8 0.08
(2)$ X+ Y\xrightleftharpoons{一定条件}2 Z$
解析
(1)根据图像可知,从反应开始到10s末,X的物质的量减少了$1.2 mol-0.4 mol=0.8 mol$,Z的物质的量浓度增大了$\frac{1.6 mol}{2 L}=0.8 mol· L^{-1}$,用Z表示的反应速率为$\frac{0.8 mol· L^{-1}}{10 s}=0.08 mol· L^{-1}· s^{-1}$。
(2)根据图像可知,从反应开始到10s末,X的物质的量减少了0.8mol,Y的物质的量减少了$1.0 mol-0.2 mol=0.8 mol$,X、Y最后都有剩余,Z的物质的量增加了1.6mol,根据各物质的物质的量变化量之比等于化学计量数之比可知,该反应的化学方程式为$ X+ Y\xrightleftharpoons{一定条件}2 Z$。
查看更多完整答案,请扫码查看


