2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第38页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
4. (2025 江苏盐城五校联考)部分含氮物质的分类与相应化合价如图所示。下列推断不合理的是 (
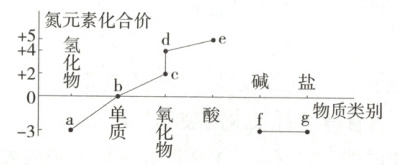
A.液态$ a $可用作制冷剂,$ g $是农业上常用的化肥
B.$ b\rightarrow a $、$ b\rightarrow c $都属于氮的固定
C.工业上由$ b $制备$ e $的路线:$ {b\xrightarrow[ 催化剂、高温高压]{{H_{2}}} a\xrightarrow[ 催化剂、加热]{{O_{2}}} c\xrightarrow{{O_{2}}} d\xrightarrow{{H_{2}O}} e} $
D.足量$ e $的稀溶液与$ 6.4\ g $铜粉反应时,可以生成$ 0.2\ mol $气体$ d $
D
)
A.液态$ a $可用作制冷剂,$ g $是农业上常用的化肥
B.$ b\rightarrow a $、$ b\rightarrow c $都属于氮的固定
C.工业上由$ b $制备$ e $的路线:$ {b\xrightarrow[ 催化剂、高温高压]{{H_{2}}} a\xrightarrow[ 催化剂、加热]{{O_{2}}} c\xrightarrow{{O_{2}}} d\xrightarrow{{H_{2}O}} e} $
D.足量$ e $的稀溶液与$ 6.4\ g $铜粉反应时,可以生成$ 0.2\ mol $气体$ d $
答案:
4.D 由题图可知,a为NH₃,b为N₂,c为NO,d为NO₂,e为HNO₃,f为NH₃·H₂O,g为铵盐。a为NH₃,液氨可以用作制冷剂,g为铵盐,是农业上常用的铵态化肥,A正确;N₂→NH₃、N₂→NO均为游离态的氮转化为化合态的氮,都属于氮的固定,B正确;工业上由N₂制备硝酸,第一步N₂在高温高压、催化剂存在条件下与H₂反应生成NH₃,第二步NH₃在催化剂、加热条件下与O₂反应生成NO,第三步NO与氧气反应生成NO₂,第四步NO₂与水反应生成HNO₃,C正确;足量稀HNO₃与Cu反应生成NO气体,不能生成NO₂,D错误。
5. (2025 河北保定期中)构建元素化合物之间的转化关系模型是学习元素化合物知识的一种方法。已知$ A $、$ B $、$ C $、$ D $、$ E $是中学化学中常见的五种物质,常温下$ E $是一种无色液体,它们之间有如下反应关系。回答下列问题:
$ {\boxed{A} + \boxed{B}\longrightarrow \boxed{C} + \boxed{D} + \boxed{E}} $
(1) 若$ B $是黄绿色气体,上述转化关系常用于实验室$ B $气体的尾气吸收,则该反应的离子方程式为
(2) 若$ A $是一种紫红色金属单质,$ B $是一种挥发性酸,反应时生成的$ C $是无色气体,反应的离子方程式是
(3) 若实验室中利用$ A $和$ B $的反应制备气体$ C $,$ C $是一种无色、有刺激性气味、密度比空气小的气体,此反应的化学方程式为
(4) 若常温下$ A $能使铁钝化,$ B $是黑色固态非金属单质,$ D $是一种能使品红溶液褪色的无色气体,$ A $和$ B $反应的化学方程式为
$ {\boxed{A} + \boxed{B}\longrightarrow \boxed{C} + \boxed{D} + \boxed{E}} $
(1) 若$ B $是黄绿色气体,上述转化关系常用于实验室$ B $气体的尾气吸收,则该反应的离子方程式为
Cl₂ + 2OH⁻ \= ClO⁻ + Cl⁻ + H₂O
。(2) 若$ A $是一种紫红色金属单质,$ B $是一种挥发性酸,反应时生成的$ C $是无色气体,反应的离子方程式是
2NO₃⁻ + 3Cu + 8H⁺ \= 2NO↑ + 4H₂O + 3Cu²⁺
,若反应中生成标准状况下$ 1.12\ L\ C $气体,则被还原的$ B $的物质的量为0.05
$ mol $。(3) 若实验室中利用$ A $和$ B $的反应制备气体$ C $,$ C $是一种无色、有刺激性气味、密度比空气小的气体,此反应的化学方程式为
2NH₄Cl + Ca(OH)₂ \=\=\== Δ CaCl₂ + 2NH₃↑ + 2H₂O
,实验室检验$ C $的方法为将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为NH₃(合理即可)
。(4) 若常温下$ A $能使铁钝化,$ B $是黑色固态非金属单质,$ D $是一种能使品红溶液褪色的无色气体,$ A $和$ B $反应的化学方程式为
C + 2H₂SO₄(浓)\=\=\== Δ CO₂↑ + 2SO₂↑ + 2H₂O
,检验$ A $的钠盐溶液中阴离子的方法是A的钠盐溶液中阴离子为SO₄²⁻,检验SO₄²⁻的方法为先加入稀盐酸,无白色沉淀,再加入BaCl₂溶液,产生白色沉淀说明存在SO₄²⁻
。
答案:
(1) $Cl_{2} + 2OH^{-} = ClO^{-} + Cl^{-} + H_{2}O$
(2) $2NO_{3}^{-} + 3Cu + 8H^{+} = 2NO↑ + 4H_{2}O + 3Cu^{2+}$ $0.05$
(3) $2NH_{4}Cl + Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2} + 2NH_{3}↑ + 2H_{2}O$ 将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为$NH_{3}$(合理即可)
(4) $C + 2H_{2}SO_{4}(浓)\xlongequal{\triangle}CO_{2}↑ + 2SO_{2}↑ + 2H_{2}O$ 取少量$A$的钠盐溶液于试管中,先加入稀盐酸,无白色沉淀,再加入$BaCl_{2}$溶液,产生白色沉淀,证明含有$SO_{4}^{2-}$解析 A、B、C、D、E是中学化学中常见的五种物质,常温下E是一种无色液体,E可能是水。
(1)黄绿色气体B为Cl₂,实验室常用NaOH溶液吸收Cl₂尾气,反应的离子方程式为Cl₂ + 2OH⁻ \= ClO⁻ + Cl⁻ + H₂O。
(2)紫红色金属单质A为Cu,挥发性酸B为HNO₃,C为NO,D为Cu(NO₃)₂,反应的离子方程式为2NO₃⁻ + 3Cu + 8H⁺ \= 2NO↑ + 4H₂O + 3Cu²⁺,生成NO的物质的量为$\frac{1.12 L}{22.4 L·mol⁻¹} = 0.05 mol,$根据氮原子守恒可知被还原的HNO₃为0.05 mol。
(3)实验室中利用A和B的反应制备气体C,C是一种无色、有刺激性气味、密度比空气小的气体,C为NH₃,实验室利用铵盐与熟石灰反应制备NH₃,化学方程式为2NH₄Cl + Ca(OH)₂ \=\=\== Δ CaCl₂ + 2NH₃↑ + 2H₂O,检验NH₃的方法为将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为NH₃,或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为NH₃。
(4)常温下A能使铁钝化,则A为浓硫酸或浓硝酸;D是一种能使品红溶液褪色的无色气体,则D为SO₂,A为浓硫酸;B是黑色固态非金属单质,则B为C,E为水,C为CO₂。A和B反应的化学方程式为C + 2H₂SO₄(浓)\=\=\== Δ CO₂↑ + 2SO₂↑ + 2H₂O;A的钠盐溶液中阴离子为SO₄²⁻,检验SO₄²⁻的方法为先加入稀盐酸,无白色沉淀,再加入BaCl₂溶液,产生白色沉淀说明存在SO₄²⁻。
5. 答案
(1) $Cl_{2} + 2OH^{-} = ClO^{-} + Cl^{-} + H_{2}O$
(2) $2NO_{3}^{-} + 3Cu + 8H^{+} = 2NO↑ + 4H_{2}O + 3Cu^{2+}$ $0.05$
(3) $2NH_{4}Cl + Ca(OH)_{2}\xlongequal{\triangle}CaCl_{2} + 2NH_{3}↑ + 2H_{2}O$ 将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为$NH_{3}$(合理即可)
(4) $C + 2H_{2}SO_{4}(浓)\xlongequal{\triangle}CO_{2}↑ + 2SO_{2}↑ + 2H_{2}O$ 取少量$A$的钠盐溶液于试管中,先加入稀盐酸,无白色沉淀,再加入$BaCl_{2}$溶液,产生白色沉淀,证明含有$SO_{4}^{2-}$
(1)黄绿色气体B为Cl₂,实验室常用NaOH溶液吸收Cl₂尾气,反应的离子方程式为Cl₂ + 2OH⁻ \= ClO⁻ + Cl⁻ + H₂O。
(2)紫红色金属单质A为Cu,挥发性酸B为HNO₃,C为NO,D为Cu(NO₃)₂,反应的离子方程式为2NO₃⁻ + 3Cu + 8H⁺ \= 2NO↑ + 4H₂O + 3Cu²⁺,生成NO的物质的量为$\frac{1.12 L}{22.4 L·mol⁻¹} = 0.05 mol,$根据氮原子守恒可知被还原的HNO₃为0.05 mol。
(3)实验室中利用A和B的反应制备气体C,C是一种无色、有刺激性气味、密度比空气小的气体,C为NH₃,实验室利用铵盐与熟石灰反应制备NH₃,化学方程式为2NH₄Cl + Ca(OH)₂ \=\=\== Δ CaCl₂ + 2NH₃↑ + 2H₂O,检验NH₃的方法为将湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为NH₃,或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为NH₃。
(4)常温下A能使铁钝化,则A为浓硫酸或浓硝酸;D是一种能使品红溶液褪色的无色气体,则D为SO₂,A为浓硫酸;B是黑色固态非金属单质,则B为C,E为水,C为CO₂。A和B反应的化学方程式为C + 2H₂SO₄(浓)\=\=\== Δ CO₂↑ + 2SO₂↑ + 2H₂O;A的钠盐溶液中阴离子为SO₄²⁻,检验SO₄²⁻的方法为先加入稀盐酸,无白色沉淀,再加入BaCl₂溶液,产生白色沉淀说明存在SO₄²⁻。
6. (2024 江苏常州联盟校月考)向$ 27.2\ g\ Cu $和$ {Cu_{2}O} $的混合物中加入某浓度的稀硝酸$ 0.5\ L $,固体物质完全反应,得到$ 8.96\ L\ NO $和$ {NO_{2}} $的混合气体(已折算为标准状况下)及$ {Cu(NO_{3})_{2}} $溶液。在所得溶液中加入$ 1.0\ mol· L^{-1} $的$ NaOH $溶液$ 1.0\ L $,恰好使金属离子完全沉淀,沉淀质量为$ 39.2\ g $。下列有关说法正确的是 (
A.硝酸浓度为$ 2.4\ mol· L^{-1} $
B.$ Cu $、$ {Cu_{2}O} $物质的量之比为$ 1:1 $
C.产生的$ {NO_{2}} $为$ 0.1\ mol $
D.固体与硝酸反应后剩余的$ {HNO_{3}} $为$ 0.2\ mol $
D
)A.硝酸浓度为$ 2.4\ mol· L^{-1} $
B.$ Cu $、$ {Cu_{2}O} $物质的量之比为$ 1:1 $
C.产生的$ {NO_{2}} $为$ 0.1\ mol $
D.固体与硝酸反应后剩余的$ {HNO_{3}} $为$ 0.2\ mol $
答案:
6.D 根据题意,溶液中加入的n(NaOH) = 1.0 mol·L⁻¹×1.0 L = 1.0 mol,恰好使Cu²⁺完全沉淀,生成Cu(OH)₂的物质的量为$\frac{39.2 g}{98 g·mol⁻¹} = 0.4 mol;$根据钠原子守恒可知最终生成1 mol NaNO₃;反应生成的NO和NO₂的总物质的量为$\frac{8.96 L}{22.4 L·mol⁻¹} = 0.4 mol,$则原稀硝酸中HNO₃的物质的量为1 mol + 0.4 mol = 1.4 mol,即$c(HNO₃) = \frac{1.4 mol}{0.5 L} = 2.8 mol·L⁻¹,$A错误;设Cu、Cu₂O物质的量分别为a mol、b mol,可列关系式$\begin{cases}a + 2b = 0.4 \\ 64a + 144b = 27.2\end{cases},$解得$\begin{cases}a = 0.2 \\ b = 0.1\end{cases},$即Cu、Cu₂O物质的量之比为2 : 1,B错误;Cu和Cu₂O在反应中失去电子的物质的量为0.2 mol×2 + 0.1 mol×2 = 0.6 mol,设产生NO和NO₂的物质的量分别为x mol、y mol,则$\begin{cases}x + y = 0.4 \\ 3x + y = 0.6\end{cases},$解得$\begin{cases}x = 0.1 \\ y = 0.3\end{cases},$故NO₂的物质的量为0.3 mol,C错误;根据氮原子守恒,知固体与硝酸反应后剩余的HNO₃的物质的量为1 mol - 0.4 mol×2 = 0.2 mol,D正确。
7. (2025 江苏苏州汾湖高级中学月考)
向$ 200\ mL $稀硫酸与稀硝酸的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是 (
已知:稀硝酸只被还原为$ NO $气体。
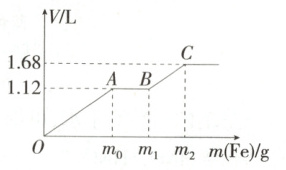
A.$ OA $段产生的气体是$ NO $,$ BC $段产生的气体是$ {H_{2}} $
B.该实验可以证明氧化性:稀硝酸$ > $稀硫酸
C.$ m_{2}=5.6 $
D.所用混合溶液中$ c{(H_{2}SO_{4})}=0.4\ mol/L $
向$ 200\ mL $稀硫酸与稀硝酸的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是 (
D
)已知:稀硝酸只被还原为$ NO $气体。

A.$ OA $段产生的气体是$ NO $,$ BC $段产生的气体是$ {H_{2}} $
B.该实验可以证明氧化性:稀硝酸$ > $稀硫酸
C.$ m_{2}=5.6 $
D.所用混合溶液中$ c{(H_{2}SO_{4})}=0.4\ mol/L $
答案:
7.D OA段发生的反应为Fe + NO₃⁻ + 4H⁺ \= Fe³⁺ + NO↑ + 2H₂O,AB段发生的反应为Fe + 2Fe³⁺ \= 3Fe²⁺,BC段发生的反应为Fe + 2H⁺ \= Fe²⁺ + H₂↑。OA段产生的气体是NO,BC段产生的气体是H₂,A正确。HNO₃、H₂SO₄同时存在时,Fe先和HNO₃发生氧化还原反应,根据氧化还原反应规律可知,氧化性:稀硝酸>稀硫酸,B正确。OA段生成NO的物质的量为1.12 L÷22.4 L/mol = 0.05 mol,根据Fe + 4H⁺ + NO₃⁻ \= Fe³⁺ + 2H₂O + NO↑,可知生成Fe³⁺的物质的量为0.05 mol,消耗Fe的物质的量为0.05 mol;根据2Fe³⁺ + Fe \= 3Fe²⁺,可知AB段又消耗0.025 mol Fe;BC段生成氢气的物质的量为(1.68 L - 1.12 L)÷22.4 L/mol = 0.025 mol,根据Fe + 2H⁺ \= Fe²⁺ + H₂↑,可知消耗Fe的物质的量为0.025 mol,参加反应的Fe的总物质的量为0.05 mol + 0.025 mol + 0.025 mol = 0.1 mol,质量为5.6 g,C正确。最终反应生成FeSO₄,根据n(Fe²⁺) = n(SO₄²⁻) = 0.1 mol,可知混合溶液中n(H₂SO₄) = 0.1 mol,则$c(H₂SO₄) = \frac{0.1 mol}{0.2 L} = 0.5 mol/L,$D错误。
查看更多完整答案,请扫码查看


