2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第27页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
5. (2025黑吉辽蒙,13)一种基于${Cu_{2}O}$的储氯电池装置如图,放电过程中$a$、$b$极均增重$^{①}$。若将$b$极换成$Ag/AgCl$电极,$b$极仍增重。关于图中装置所示电池,下列说法错误的是 (
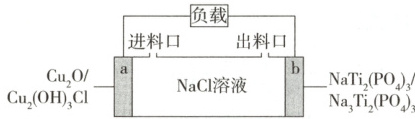
A.放电时${Na^{+}}$向$b$极迁移
B.该电池可用于海水脱盐
C.$a$极反应:${Cu_{2}O + 2H_{2}O + Cl^{-} - 2e^{-}\xlongequal{}Cu_{2}(OH)_{3}Cl + H^{+}}$
D.若以$Ag/AgCl$电极代替$a$极,电池将失去储氯能力
D
)
A.放电时${Na^{+}}$向$b$极迁移
B.该电池可用于海水脱盐
C.$a$极反应:${Cu_{2}O + 2H_{2}O + Cl^{-} - 2e^{-}\xlongequal{}Cu_{2}(OH)_{3}Cl + H^{+}}$
D.若以$Ag/AgCl$电极代替$a$极,电池将失去储氯能力
答案:
5.D
真题降维
放电过程中a、b极均增重,说明a电极的电极反应式为Cu₂O+H₂O+Cl⁻−2e⁻=Cu₂(OH)₃Cl+H⁺,a电极为负极,C项正确;b电极的电极反应式为NaTi₂(PO₄)₃+2e⁻+2Na⁺=Na₃Ti₂(PO₄)₃,b电极为正极。
a极为负极,b极为正极,则放电时Na⁺向正极迁移,即向b极迁移,A项正确。根据电极反应式知,放电时,负极消耗Cl⁻,正极消耗Na⁺,故可用于海水脱盐,B项正确。根据题干信息,若将b极换为Ag/AgCl电极,b极仍增重,说明此时b极上的电极反应式为Ag+Cl⁻−e⁻=AgCl,则Ag/AgCl电极为负极,a极为正极,正极上Cu₂(OH)₃Cl转化为Cu₂O,说明还原性:Ag>Cu₂O>NaTi₂(PO₄)₃,故若以Ag/AgCl电极代替a极,Ag/AgCl电极仍为负极,NaTi₂(PO₄)₃/Na₃Ti₂(PO₄)₃为正极,负极上的电极反应式为Ag+Cl⁻−e⁻=AgCl,电池仍有储氯能力,D项错误。
真题降维
放电过程中a、b极均增重,说明a电极的电极反应式为Cu₂O+H₂O+Cl⁻−2e⁻=Cu₂(OH)₃Cl+H⁺,a电极为负极,C项正确;b电极的电极反应式为NaTi₂(PO₄)₃+2e⁻+2Na⁺=Na₃Ti₂(PO₄)₃,b电极为正极。
a极为负极,b极为正极,则放电时Na⁺向正极迁移,即向b极迁移,A项正确。根据电极反应式知,放电时,负极消耗Cl⁻,正极消耗Na⁺,故可用于海水脱盐,B项正确。根据题干信息,若将b极换为Ag/AgCl电极,b极仍增重,说明此时b极上的电极反应式为Ag+Cl⁻−e⁻=AgCl,则Ag/AgCl电极为负极,a极为正极,正极上Cu₂(OH)₃Cl转化为Cu₂O,说明还原性:Ag>Cu₂O>NaTi₂(PO₄)₃,故若以Ag/AgCl电极代替a极,Ag/AgCl电极仍为负极,NaTi₂(PO₄)₃/Na₃Ti₂(PO₄)₃为正极,负极上的电极反应式为Ag+Cl⁻−e⁻=AgCl,电池仍有储氯能力,D项错误。
6. (2024江苏,8改编)碱性锌锰电池的总反应为${Zn + 2MnO_{2} + 2H_{2}O\xlongequal{}Zn(OH)_{2} + 2MnOOH}$,电池构造示意图如图所示。下列有关说法正确的是 (
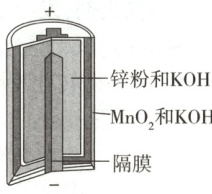
A.电池工作时,${MnO_{2}}$发生氧化反应
B.电池工作时,${OH^{-}}$通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成$1\ \mathrm{mol}\ MnOOH$,转移电子数为$2×6.02×10^{23}$
C
)
A.电池工作时,${MnO_{2}}$发生氧化反应
B.电池工作时,${OH^{-}}$通过隔膜向正极移动
C.环境温度过低,不利于电池放电
D.反应中每生成$1\ \mathrm{mol}\ MnOOH$,转移电子数为$2×6.02×10^{23}$
答案:
6.C 由题给电池总反应可知,Zn为负极,电极反应式为Zn+2OH⁻−2e⁻=Zn(OH)₂(氧化反应),MnO₂为正极,电极反应式为2MnO₂+2H₂O+2e⁻=2MnOOH+2OH⁻(还原反应),电池工作时,OH⁻通过隔膜向负极移动,A、B错误;环境温度过低时,化学反应速率减小,不利于电池放电,C正确;电池放电时,Mn元素化合价由+4价降至+3价,则反应中每生成1molMnOOH,转移1mol电子,即转移电子数约为6.02×10²³,D项错误。
7. (2023辽宁,11)某低成本储能电池原理如下图所示。下列说法正确的是 (

A.放电时负极质量减小$^{①}$
B.储能过程中电能转变为化学能
C.放电时右侧${H^{+}}$通过质子交换膜移向左侧
D.充电总反应:${Pb + SO^{2-}_{4} + 2Fe^{3+}\xlongequal{}PbSO_{4} + 2Fe^{2+}}$
B
)
A.放电时负极质量减小$^{①}$
B.储能过程中电能转变为化学能
C.放电时右侧${H^{+}}$通过质子交换膜移向左侧
D.充电总反应:${Pb + SO^{2-}_{4} + 2Fe^{3+}\xlongequal{}PbSO_{4} + 2Fe^{2+}}$
答案:
7.B
真题降维
①辅助设问答案:通过联想铅酸蓄电池的工作原理,可判断左侧电极为负极→快速判断A、C选项。
该储能电池是二次电池,放电时左侧的电极为负极,电极反应式为Pb+SO₄²⁻−2e⁻=PbSO₄,右侧的电极为正极,电极反应式为Fe³⁺+e⁻=Fe²⁺。放电时负极上Pb转变为PbSO₄,负极质量增大,A项错误;储能时电能转化为化学能,B项正确;放电时H⁺向正极移动,故H⁺通过质子交换膜向右侧移动,C项错误;由放电时两极的电极反应式可知,放电总反应为Pb+SO₄²⁻+2Fe³⁺=PbSO₄+2Fe²⁺,D项错误。
名师点津
铅酸蓄电池
1.构造:铅酸蓄电池是一种常见的二次电池。它由两组栅状极板交替排列而成,正极板上覆盖有PbO₂,负极板上覆盖有Pb,稀硫酸作电解质溶液(如图)。
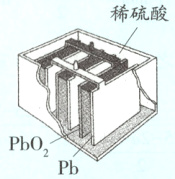
2.电极反应:铅酸蓄电池放电时的电极反应如下。
负极:Pb+SO₄²⁻−2e⁻=PbSO₄
正极:PbO₂+4H⁺+SO₄²⁻+2e⁻=PbSO₄+2H₂O
总反应:Pb+PbO₂+2H₂SO₄=2PbSO₄+2H₂O
铅酸蓄电池的充电过程与其放电过程相反。
3.优缺点:铅酸蓄电池电压稳定、使用方便、安全可靠、价格低廉,因此在生产、生活中使用广泛。例如,铅酸蓄电池多用于启动和维持汽车用电系统的正常运转。铅酸蓄电池的缺点是比能量低、笨重。
7.B
真题降维
①辅助设问答案:通过联想铅酸蓄电池的工作原理,可判断左侧电极为负极→快速判断A、C选项。
该储能电池是二次电池,放电时左侧的电极为负极,电极反应式为Pb+SO₄²⁻−2e⁻=PbSO₄,右侧的电极为正极,电极反应式为Fe³⁺+e⁻=Fe²⁺。放电时负极上Pb转变为PbSO₄,负极质量增大,A项错误;储能时电能转化为化学能,B项正确;放电时H⁺向正极移动,故H⁺通过质子交换膜向右侧移动,C项错误;由放电时两极的电极反应式可知,放电总反应为Pb+SO₄²⁻+2Fe³⁺=PbSO₄+2Fe²⁺,D项错误。
名师点津
铅酸蓄电池
1.构造:铅酸蓄电池是一种常见的二次电池。它由两组栅状极板交替排列而成,正极板上覆盖有PbO₂,负极板上覆盖有Pb,稀硫酸作电解质溶液(如图)。

2.电极反应:铅酸蓄电池放电时的电极反应如下。
负极:Pb+SO₄²⁻−2e⁻=PbSO₄
正极:PbO₂+4H⁺+SO₄²⁻+2e⁻=PbSO₄+2H₂O
总反应:Pb+PbO₂+2H₂SO₄=2PbSO₄+2H₂O
铅酸蓄电池的充电过程与其放电过程相反。
3.优缺点:铅酸蓄电池电压稳定、使用方便、安全可靠、价格低廉,因此在生产、生活中使用广泛。例如,铅酸蓄电池多用于启动和维持汽车用电系统的正常运转。铅酸蓄电池的缺点是比能量低、笨重。
8. (2024新课标,12)一种可植入体内的微型电池工作原理如图所示,通过$CuO$催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)
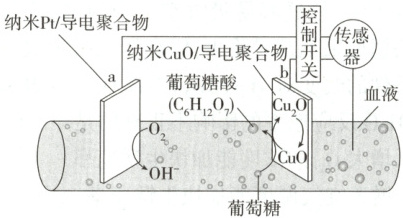
电池工作时,下列叙述错误的是 (
A.电池总反应为${2C_{6}H_{12}O_{6} + O_{2}\xlongequal{}2C_{6}H_{12}O_{7}}$
B.$b$电极上$CuO$通过$Cu$(Ⅱ)和$Cu$(Ⅰ)相互转变起催化作用
C.消耗$18\ \mathrm{mg}$葡萄糖,理论上$a$电极有$0.4\ \mathrm{mmol}$电子流入
D.两电极间血液中的${Na^{+}}$在电场驱动下的迁移方向为$b\rightarrow a$

电池工作时,下列叙述错误的是 (
C
)A.电池总反应为${2C_{6}H_{12}O_{6} + O_{2}\xlongequal{}2C_{6}H_{12}O_{7}}$
B.$b$电极上$CuO$通过$Cu$(Ⅱ)和$Cu$(Ⅰ)相互转变起催化作用
C.消耗$18\ \mathrm{mg}$葡萄糖,理论上$a$电极有$0.4\ \mathrm{mmol}$电子流入
D.两电极间血液中的${Na^{+}}$在电场驱动下的迁移方向为$b\rightarrow a$
答案:
8.C 电池工作时,a电极上O₂→OH⁻,发生还原反应,电极反应式为O₂+4e⁻+2H₂O=4OH⁻,a电极为正极;b电极为负极,发生反应Cu₂O−2e⁻+2OH⁻=2CuO+H₂O,C₆H₁₂O₆+2CuO=C₆H₁₂O₇+2CuO,可得电池总反应为2C₆H₁₂O₆+O₂=2C₆H₁₂O₇,A正确;由b电极上发生的反应可知,b电极上CuO通过Cu(Ⅱ)和Cu(Ⅰ)相互转变起催化作用,B正确。
18mg葡萄糖的物质的量为18mg/180g/mol=0.1mmol,由2C₆H₁₂O₆+O₂=2C₆H₁₂O₇可知,消耗18mg葡萄糖,理论上a电极上消耗0.05mmolO₂,转移0.05mmol×4=0.2mmol电子,C错误。原电池中,阳离子由负极移向正极,则Na⁺的迁移方向为b→a,D正确。
名师点津
解答本题时应注意在两电极分别发生的反应,由题图知,在正极氧气得电子生成OH⁻,负极电极反应为Cu₂O−2e⁻+2OH⁻=2CuO+H₂O,不是C₆H₁₂O₆(葡萄糖)直接参与电极反应。
18mg葡萄糖的物质的量为18mg/180g/mol=0.1mmol,由2C₆H₁₂O₆+O₂=2C₆H₁₂O₇可知,消耗18mg葡萄糖,理论上a电极上消耗0.05mmolO₂,转移0.05mmol×4=0.2mmol电子,C错误。原电池中,阳离子由负极移向正极,则Na⁺的迁移方向为b→a,D正确。
名师点津
解答本题时应注意在两电极分别发生的反应,由题图知,在正极氧气得电子生成OH⁻,负极电极反应为Cu₂O−2e⁻+2OH⁻=2CuO+H₂O,不是C₆H₁₂O₆(葡萄糖)直接参与电极反应。
9. (2023全国甲,12)用可再生能源电还原${CO_{2}}$时,采用高浓度的${K^{+}}$抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是 (
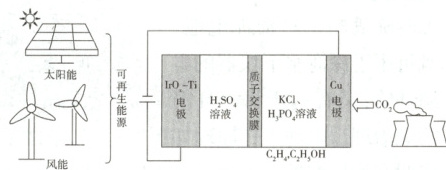
A.析氢反应发生在${IrO_{x}-Ti}$电极上
B.${Cl^{-}}$从$Cu$电极迁移到${IrO_{x}-Ti}$电极
C.阴极发生的反应有:${2CO_{2} + 12H^{+} + 12e^{-}\xlongequal{}C_{2}H_{4} + 4H_{2}O}$
D.每转移$1\ \mathrm{mol}$电子,阳极生成$11.2\ \mathrm{L}$气体(标准状况)
C
)
A.析氢反应发生在${IrO_{x}-Ti}$电极上
B.${Cl^{-}}$从$Cu$电极迁移到${IrO_{x}-Ti}$电极
C.阴极发生的反应有:${2CO_{2} + 12H^{+} + 12e^{-}\xlongequal{}C_{2}H_{4} + 4H_{2}O}$
D.每转移$1\ \mathrm{mol}$电子,阳极生成$11.2\ \mathrm{L}$气体(标准状况)
答案:
9.C 析氢反应过程得电子,为还原反应,在阴极(Cu电极)上发生,A错误;电解池中阴离子向阳极移动,但此装置中使用了质子交换膜,只能允许H⁺通过,Cl⁻无法从Cu电极迁移到IrOₓ−Ti电极,B错误;阴极发生的电极反应有2CO₂+12H⁺+12e⁻=C₂H₄+4H₂O、2CO₂+12H⁺+12e⁻=C₂H₅OH+3H₂O,C正确;阳极区电解质溶液为硫酸溶液,阳极电极反应式为2H₂O−4e⁻=O₂↑+4H⁺,则每转移1mol电子生成0.25molO₂,在标准状况下的体积为5.6L,D错误。
高考风向
近些年,“碳达峰、碳中和”是热点,围绕二氧化碳的利用与清除设置题目是热门考点。
本题与2019年江苏卷第20题
(2)电解法转化CO₂制HCOOH相似,都是以电解法转化CO₂生成有机物为情境,均考查了电解池电极反应式的书写,隔膜在离子移动或物质浓度变化中的应用;本题还考查了离子的移动方向和电解相关计算等,2019年江苏卷第20题
(2)还考查了电解过程中物质的浓度变化原因。
高考风向
近些年,“碳达峰、碳中和”是热点,围绕二氧化碳的利用与清除设置题目是热门考点。
本题与2019年江苏卷第20题
(2)电解法转化CO₂制HCOOH相似,都是以电解法转化CO₂生成有机物为情境,均考查了电解池电极反应式的书写,隔膜在离子移动或物质浓度变化中的应用;本题还考查了离子的移动方向和电解相关计算等,2019年江苏卷第20题
(2)还考查了电解过程中物质的浓度变化原因。
查看更多完整答案,请扫码查看


