2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
1. (2024 江苏昆山柏庐高级中学月考)现有一定量的$Cu$和$CuO$的混合物,向其中加入${1.2\ \mathrm{L}\ 2.0\ \mathrm{mol· L^{-1}}}$稀硝酸,混合物完全溶解,同时生成${8.96\ \mathrm{L}\ NO}$(标准状况下)。向所得溶液中加入一定体积${2.0\ \mathrm{mol· L^{-1}}\ NaOH}$溶液,恰好使${Cu^{2+}}$沉淀完全,沉淀经洗涤、充分灼烧后得${64.0\ \mathrm{g}}$黑色固体(忽略溶液的体积变化)。下列说法正确的是 (
A.与该混合物反应消耗的${HNO_{3}}$的物质的量为${1.2\ \mathrm{mol}}$
B.该混合物中铜与氧化铜物质的量之比为$1:3$
C.加入$NaOH$溶液的体积是${1\ \mathrm{L}}$
D.${Cu^{2+}}$沉淀完全后,溶液中${\mathit{c}(NO^{-}_{3})}$为${1.1\ \mathrm{mol· L^{-1}}}$
C
)A.与该混合物反应消耗的${HNO_{3}}$的物质的量为${1.2\ \mathrm{mol}}$
B.该混合物中铜与氧化铜物质的量之比为$1:3$
C.加入$NaOH$溶液的体积是${1\ \mathrm{L}}$
D.${Cu^{2+}}$沉淀完全后,溶液中${\mathit{c}(NO^{-}_{3})}$为${1.1\ \mathrm{mol· L^{-1}}}$
答案:
1.C Cu与稀HNO₃反应的化学方程式为3Cu+8HNO₃(稀)=3Cu(NO₃)₂+2NO↑+4H₂O,生成标准状况下8.96LNO,即生成0.4molNO,反应消耗的n(Cu)=$\frac{0.4mol×3}{2}$ = 0.6mol;最终得到的CuO为64.0g,物质的量为0.8mol,根据铜原子守恒可知原混合物中CuO的物质的量为0.8mol - 0.6mol = 0.2mol。根据N原子守恒,反应中消耗的n(HNO₃)=0.8mol×2 + 0.4mol = 2mol,A错误;结合上述分析可知原混合物中Cu、CuO分别为0.6mol和0.2mol,其物质的量之比为3:1,B错误;反应后剩余的HNO₃的物质的量为2.0mol·L⁻¹×1.2L - 2.0mol = 0.4mol,则NaOH先中和过量HNO₃,再与Cu²⁺反应,共消耗n(NaOH)=0.4mol + 0.8mol×2 = 2.0mol,即V(NaOH溶液)=$\frac{2.0mol}{2.0mol·L⁻¹}$ = 1L,C正确;Cu²⁺完全沉淀时,溶液中含2molNO₃⁻,即溶液中c(NO₃⁻)=$\frac{2mol}{1.2L + 1L}$≈0.91mol·L⁻¹,D错误。
方法点津
解答本题主要应用原子守恒和氧化还原反应中的得失电子守恒,运用守恒法对题中数据进行分析和计算,可使复杂的计算简单化,在解答类似计算题时要加以尝试。
方法点津
解答本题主要应用原子守恒和氧化还原反应中的得失电子守恒,运用守恒法对题中数据进行分析和计算,可使复杂的计算简单化,在解答类似计算题时要加以尝试。
2. (2025 湖南长沙第十五中学期末)$FeS$与一定浓度的硝酸反应,生成了${Fe_{2}(SO_{4})_{3}}$、${Fe(NO_{3})_{3}}$、$NO$、${NO_{2}}$、${N_{2}O_{4}}$和${H_{2}O}$,当$NO$、${NO_{2}}$和${N_{2}O_{4}}$分子的个数之比为$2:1:1$时,实际参加反应的$FeS$与${HNO_{3}}$的物质的量之比为 (
A.$1:6$
B.$1:7$
C.$1:8$
D.$1:9$
A
)A.$1:6$
B.$1:7$
C.$1:8$
D.$1:9$
答案:
2.A 设参加反应的FeS为3mol,则根据S原子守恒可知生成1molFe₂(SO₄)₃,根据Fe原子守恒可知生成1molFe(NO₃)₃,Fe元素化合价由+2价升高为+3价,S元素化合价由 - 2价升高为+6价,所以3molFeS共失去27mol电子,根据得失电子守恒可知HNO₃共得到27mol电子,生成NO、NO₂和N₂O₄;设NO、NO₂和N₂O₄的物质的量分别为2x、x、x,则有2x×3 + x + 2x = 27mol,解得x = 3mol,即NO、NO₂和N₂O₄的物质的量分别为6mol、3mol、3mol;根据N原子守恒可知HNO₃的物质的量为1mol×3 + 6mol + 3mol + 3mol×2 = 18mol,所以实际参加反应的FeS与HNO₃的物质的量之比为3mol:18mol = 1:6。
3. (2025 江苏扬州月考)$Cu$与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在$NaOH$溶液中得到${NaNO_{3}}$和${NaNO_{2}}$的混合溶液,反应过程及有关数据如图所示:

下列有关判断正确的是 (
A.常温下,$Cu$遇浓硝酸发生钝化,不可能发生上述反应
B.收集的氮氧化物的体积为${20.16\ \mathrm{L}}$
C.反应过程中生成的${Cu(NO_{3})_{2}}$既是氧化产物,又是还原产物
D.若铜片为${51.2\ \mathrm{g}}$,则生成${0.2\ \mathrm{mol}\ NaNO_{3}}$

下列有关判断正确的是 (
D
)A.常温下,$Cu$遇浓硝酸发生钝化,不可能发生上述反应
B.收集的氮氧化物的体积为${20.16\ \mathrm{L}}$
C.反应过程中生成的${Cu(NO_{3})_{2}}$既是氧化产物,又是还原产物
D.若铜片为${51.2\ \mathrm{g}}$,则生成${0.2\ \mathrm{mol}\ NaNO_{3}}$
答案:
3.D 常温下,Cu遇浓硝酸不会钝化,Cu能与浓硝酸反应生成NO₂等,A错误;气体所处状况未知,无法计算其体积,B错误;反应过程中生成的Cu(NO₃)₂是氧化产物,C错误;分析整个反应过程可知仅有两种元素的化合价发生变化,Cu→Cu²⁺、HNO₃→NaNO₂,51.2gCu的物质的量为0.8mol,共失电子0.8mol×2 = 1.6mol,由得失电子守恒可知HNO₃→NaNO₂得1.6mol电子,故产物中NaNO₂的物质的量为0.8mol,由Na守恒可知另一种产物NaNO₃为0.2mol,D正确。
方法点津
解答金属与酸(含混酸)的相关计算问题,往往需要利用守恒法;同学们在利用守恒法时可以抛开复杂的转化过程,只需找到始态和终态某一特定的量是固定不变的即可。
方法点津
解答金属与酸(含混酸)的相关计算问题,往往需要利用守恒法;同学们在利用守恒法时可以抛开复杂的转化过程,只需找到始态和终态某一特定的量是固定不变的即可。
4. (2025 江苏无锡期中)实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测,所得固体中含有${Cu_{2}S}$和白色物质$X$,下列说法错误的是 (
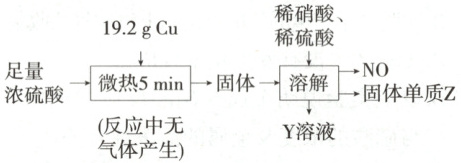
A.白色物质$X$为${CuSO_{4}}$
B.微热${5\ \mathrm{min}}$待$Cu$反应结束后,转移电子的物质的量为${0.48\ \mathrm{mol}}$
C.放出的$NO$在标准状况下的体积为${0.896\ \mathrm{L}}$
D.固体单质$Z$是硫单质
C
)
A.白色物质$X$为${CuSO_{4}}$
B.微热${5\ \mathrm{min}}$待$Cu$反应结束后,转移电子的物质的量为${0.48\ \mathrm{mol}}$
C.放出的$NO$在标准状况下的体积为${0.896\ \mathrm{L}}$
D.固体单质$Z$是硫单质
答案:
4.C Cu与浓硫酸发生反应,生成的白色固体为CuSO₄,A正确;n(Cu)=$\frac{19.2g}{64g·mol⁻¹}$ = 0.3mol,设反应生成的Cu₂S为xmol,则CuSO₄为(0.3 - 2x)mol,由得失电子守恒得2x + 2×(0.3 - 2x)=8x,解得x = 0.06,即Cu₂S为0.06mol,CuSO₄为0.18mol,故微热5min待Cu反应结束后,转移电子的物质的量为0.06mol×2 + 0.18mol×2 = 0.48mol,B正确;结合图示可知0.06molCu₂S与HNO₃、H₂SO₄发生氧化还原反应生成CuSO₄、S、NO,由得失电子守恒可知生成的NO在标准状况下的体积为$\frac{0.06mol×4}{3}$×22.4L·mol⁻¹ = 1.792L,C错误;由C项分析可知Z是硫单质,D正确。
查看更多完整答案,请扫码查看


