2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
1. (2024江苏扬州高邮联考)铁容易生锈,除了本身化学性质以外,与外界条件也有很大关系。铁与氧气在有水的环境中反应,生成${Fe_{2}O_{3}· xH_{2}O}$,它是铁锈的主要成分,铁生锈的总反应为${4Fe + 3O_{2} + xH_{2}O\xlongequal{}2Fe_{2}O_{3}· 2xH_{2}O}$。铁锈容易吸收空气中的水,铁表面的铁锈如果不及时除去,铁会锈蚀得很快。下列条件的改变对${4Fe + 3O_{2} + 2xH_{2}O\xlongequal{}2Fe_{2}O_{3}· xH_{2}O}$反应速率的影响不正确的是 (
A.增大${O_{2}}$的浓度能加快生锈速率
B.增大空气湿度能加快生锈速率
C.在铁表面刷一层漆能加快生锈速率
D.升高温度能加快生锈速率
C
)A.增大${O_{2}}$的浓度能加快生锈速率
B.增大空气湿度能加快生锈速率
C.在铁表面刷一层漆能加快生锈速率
D.升高温度能加快生锈速率
答案:
1.C 增大反应物O₂浓度,反应速率加快,能加快生锈速率,A正确;铁与O₂在有水的环境中易反应,故增大空气湿度能加快铁生锈的速率,B正确;在铁表面刷漆能隔绝空气,使铁不易生锈,C错误;升高温度,反应速率加快,能加快生锈速率,D正确。
素养解读
本题结合生活中铁锈蚀的条件,考查外界条件改变对化学反应速率的影响,体现了证据推理与模型认知、科学态度与社会责任的化学学科核心素养。
素养解读
本题结合生活中铁锈蚀的条件,考查外界条件改变对化学反应速率的影响,体现了证据推理与模型认知、科学态度与社会责任的化学学科核心素养。
2. (2021广东高考)反应${X\xlongequal{}2Z}$经历两步:①$X\longrightarrow Y$;②$Y\longrightarrow_{2}Z$。反应体系中$X$、$Y$、$Z$的浓度$c$随时间$t$的变化曲线如图所示。下列说法不正确的是 (
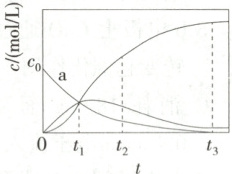
A.$a$为$c(X)$随$t$的变化曲线
B.$t_{1}$时,$c(X)=c(Y)=c(Z)$
C.$t_{2}$时,$Y$的消耗速率大于生成速率
D.$t_{3}$后,$c(Z)=2c_{0}-c(Y)$
D
)
A.$a$为$c(X)$随$t$的变化曲线
B.$t_{1}$时,$c(X)=c(Y)=c(Z)$
C.$t_{2}$时,$Y$的消耗速率大于生成速率
D.$t_{3}$后,$c(Z)=2c_{0}-c(Y)$
答案:
2.D 由于反应X=2Z分①X→Y和②Y→2Z两步进行,随着不断反应,X的浓度逐渐减小,Y的浓度先增大后减小,Z的浓度逐渐增大,由此可判断如下图:
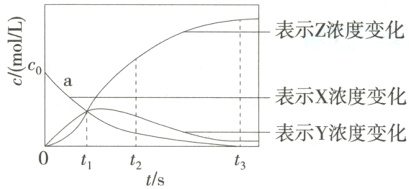
结合上述分析可知,a表示c(X)随t的变化曲线,A项正确;t₁时,三条曲线交于一点,则此时三种物质的物质的量浓度相等,B项正确;t₂后Y的物质的量浓度在减小,说明Y的消耗速率大于生成速率,C项正确;由题图可知,t₃后X的浓度为0,若全生成Z,则c(Z)=2c₀,体系中存在一定量的Y,由②可知,体系中c(Z)=2c₀−2c(Y),D项错误。
2.D 由于反应X=2Z分①X→Y和②Y→2Z两步进行,随着不断反应,X的浓度逐渐减小,Y的浓度先增大后减小,Z的浓度逐渐增大,由此可判断如下图:

结合上述分析可知,a表示c(X)随t的变化曲线,A项正确;t₁时,三条曲线交于一点,则此时三种物质的物质的量浓度相等,B项正确;t₂后Y的物质的量浓度在减小,说明Y的消耗速率大于生成速率,C项正确;由题图可知,t₃后X的浓度为0,若全生成Z,则c(Z)=2c₀,体系中存在一定量的Y,由②可知,体系中c(Z)=2c₀−2c(Y),D项错误。
3. (2025江苏无锡阶段测试)“海泥电池”既可用于深海水下仪器的电源补给,又有利于海洋环境污染治理。电池工作原理如图所示,其中微生物代谢产物显酸性。下列说法正确的是 (
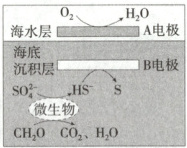
A.微生物作用下发生反应:${2CH_{2}O + SO^{2-}_{4} + H^{+}\xlongequal{}2CO_{2} + HS^{-} + 2H_{2}O}$
B.${H^{+}}$从海水层通过交接面向海底沉积层移动
C.除去$6.0\ \mathrm{g}\ {CH_{2}O}$,$A$电极消耗$2.24\ \mathrm{L}\ {O_{2}}$
D.温度越高,反应进行越迅速,污染治理效果越好
A
)
A.微生物作用下发生反应:${2CH_{2}O + SO^{2-}_{4} + H^{+}\xlongequal{}2CO_{2} + HS^{-} + 2H_{2}O}$
B.${H^{+}}$从海水层通过交接面向海底沉积层移动
C.除去$6.0\ \mathrm{g}\ {CH_{2}O}$,$A$电极消耗$2.24\ \mathrm{L}\ {O_{2}}$
D.温度越高,反应进行越迅速,污染治理效果越好
答案:
3.A 由题图可知,A电极是正极,B电极是负极。微生物作用下CH₃OH和硫酸根离子在酸性条件下生成二氧化碳、HS⁻和水,离子方程式为2CH₃OH+SO₄²⁻+H⁺=2CO₂+HS⁻+2H₂O,A正确;阳离子向正极移动,则H⁺从海底沉积层通过交接面向海水层移动,B错误;没有指出气体所处状况,不确定消耗氧气的体积,C错误;温度过高会使微生物失去活性,导致反应速率减慢,D错误。
4. (2024江苏扬州仪征中学月考)用${Cl_{2}}$生产某些含氯有机物时会产生副产物$HCl$。利用反应$A$,可实现氯的循环利用。
反应$A$:${4HCl + O_{2}\xlongequal[\Delta]{CuO/CuCl_{2}} 2Cl_{2} + 2H_{2}O}$
已知:
Ⅰ.反应$A$中,$4\ \mathrm{mol}\ HCl$被氧化,放出$115.6\ \mathrm{kJ}$的热量。
Ⅱ.
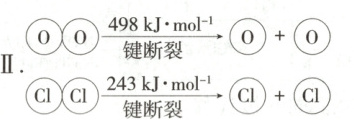
下列说法正确的是 (
A.反应$A$的$\Delta H=115.6\ \mathrm{kJ·\ mol^{-1}}$
B.${H_{2}O}$中$H-O$键的键能比$HCl$中$H-Cl$键的键能小
C.由Ⅱ中的数据判断氯元素的非金属性比氧元素强
D.断开$1\ \mathrm{mol}\ H-O$键与断开$1\ \mathrm{mol}\ H-Cl$键所需能量相差约$32\ \mathrm{kJ}$
反应$A$:${4HCl + O_{2}\xlongequal[\Delta]{CuO/CuCl_{2}} 2Cl_{2} + 2H_{2}O}$
已知:
Ⅰ.反应$A$中,$4\ \mathrm{mol}\ HCl$被氧化,放出$115.6\ \mathrm{kJ}$的热量。
Ⅱ.

下列说法正确的是 (
D
)A.反应$A$的$\Delta H=115.6\ \mathrm{kJ·\ mol^{-1}}$
B.${H_{2}O}$中$H-O$键的键能比$HCl$中$H-Cl$键的键能小
C.由Ⅱ中的数据判断氯元素的非金属性比氧元素强
D.断开$1\ \mathrm{mol}\ H-O$键与断开$1\ \mathrm{mol}\ H-Cl$键所需能量相差约$32\ \mathrm{kJ}$
答案:
4.D 反应A中4molHCl被氧化,放出115.6kJ的热量,所以反应A的ΔH=−115.6kJ·mol⁻¹,A错误;用E(H−O)、E(H−Cl)分别表示H−O键的键能、H−Cl键的键能,反应A中,4molHCl被氧化,放出115.6kJ的热量,ΔH=反应物总键能−生成物总键能,故4×E(H−Cl)+498kJ·mol⁻¹−[2×243kJ·mol⁻¹+4×E(H−O)]=−115.6kJ·mol⁻¹,整理得4E(H−Cl)−4E(H−O)=−127.6kJ·mol⁻¹,故断开1molH−O键与断开1molH−Cl键所需能量相差127.6/4kJ=31.9kJ≈32kJ,H₂O中H−O键的键能比HCl中H−Cl键的键能大,故B错误,D正确;氧气能够将Cl⁻氧化为氯气,氯元素的非金属性比氧元素弱,故C错误。
5. (2024河北衡水期中联考)在一个容积不变的$2\ \mathrm{L}$密闭容器中加入$2\ \mathrm{mol}\ {SO_{2}}$、$1\ \mathrm{mol}\ {O_{2}}$和合适的催化剂,发生反应${2SO_{2}(g) + O_{2}(g)⇌ 2SO_{3}(g)}$,该反应为放热反应,同时研究温度对${SO_{2}}$的平衡转化率和催化剂的催化效率的影响,如下图所示:
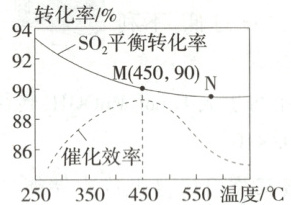
已知:${SO_{2}}$的平衡转化率$=\dfrac{ 初始时{SO_{2}} 的物质的量- 平衡时{SO_{2}} 的物质的量}{ 初始时{SO_{2}} 的物质的量}×100\%$。下列说法正确的是 (
A.合成${SO_{3}}$的最佳条件是加催化剂,温度为$250\ ^{\circ} C$
B.$450\ ^{\circ} C$时,若$5\ \mathrm{min}$达到平衡,则$v({O_{2}})=0.09\ \mathrm{mol·\ L^{-1}· min^{-1}}$
C.升高温度,正反应速率增大,逆反应速率减小
D.${SO_{3}}$的生成速率:$v(N)$一定大于$v(M)$

已知:${SO_{2}}$的平衡转化率$=\dfrac{ 初始时{SO_{2}} 的物质的量- 平衡时{SO_{2}} 的物质的量}{ 初始时{SO_{2}} 的物质的量}×100\%$。下列说法正确的是 (
B
)A.合成${SO_{3}}$的最佳条件是加催化剂,温度为$250\ ^{\circ} C$
B.$450\ ^{\circ} C$时,若$5\ \mathrm{min}$达到平衡,则$v({O_{2}})=0.09\ \mathrm{mol·\ L^{-1}· min^{-1}}$
C.升高温度,正反应速率增大,逆反应速率减小
D.${SO_{3}}$的生成速率:$v(N)$一定大于$v(M)$
答案:
5.B 加入催化剂可加快反应速率,缩短反应达到平衡的时间,合成SO₃的最佳条件是加入催化剂,温度为450℃,A错误;450℃时,SO₂的平衡转化率为90%,此时参加反应的SO₂为2mol×90%=1.8mol,若1.8mol/2L/5min=0.18mol·L⁻¹·min⁻¹,由速率之比等于化学计量数之比可得v(O₂)=1/2v(SO₂)=0.09mol·L⁻¹·min⁻¹,B正确;升高温度,正、逆反应速率均增大,C错误;N点温度高于M点,但N点催化剂的催化效率低于M点,所以v(N)有可能小于v(M),D错误。
查看更多完整答案,请扫码查看


