2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第15页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
1.(2025 福建厦门月考) 理论上不能设计为原电池的化学反应是 (
A.$2 FeCl_3 + Fe \longequal{} 3 FeCl_2$
B.$ HNO_3 + NaOH \longequal{} NaNO_3 + H_2 O$
C.$2 H_2 + O_2 \longequal{} 2 H_2 O$
D.$ CH_4 + 2 O_2 \longequal{} CO_2 + 2 H_2 O$
B
)A.$2 FeCl_3 + Fe \longequal{} 3 FeCl_2$
B.$ HNO_3 + NaOH \longequal{} NaNO_3 + H_2 O$
C.$2 H_2 + O_2 \longequal{} 2 H_2 O$
D.$ CH_4 + 2 O_2 \longequal{} CO_2 + 2 H_2 O$
答案:
1.B 氯化铁和铁的反应是自发的氧化还原反应,可以设计成原电池,A不符合题意;硝酸和氢氧化钠的反应前后无元素化合价变化,不是氧化还原反应,不能设计成原电池,B符合题意;氢气和氧气的反应是自发的氧化还原反应,可以设计成原电池,C不符合题意;甲烷和氧气的反应是自发的氧化还原反应,可以设计成原电池,D不符合题意。
2.(2024 河南多校期中联考) 下列装置不能形成原电池的是 (

A.①⑤⑥⑦
B.①②③⑤
C.②④⑥⑦
D.①②③④
A
)
A.①⑤⑥⑦
B.①②③⑤
C.②④⑥⑦
D.①②③④
答案:
2.A ①没有形成闭合回路,不能形成原电池,符合题意;②Zn比Cu活泼,Zn和硫酸铜能自发进行氧化还原反应,有闭合回路,能形成原电池,不符合题意;③Zn与Fe、稀硫酸形成闭合回路,Zn与H₂SO₄能自发进行氧化还原反应,能形成原电池,不符合题意;④Zn和醋酸能自发进行氧化还原反应,Zn和Pb活泼性不同,Zn、Pb和醋酸溶液形成闭合回路,能形成原电池,不符合题意;⑤两个电极都是Zn,没有活泼性差异,不能形成原电池,符合题意;⑥乙醇不能导电,不能形成原电池,符合题意;⑦未形成闭合回路,不能形成原电池,符合题意;A正确。
3.(2025 江苏盐城期中) 电池因能提供持久稳定的电力支持, 满足不同领域的需求而应用广泛。如图为铁—碳原电池的装置示意图, 下列说法正确的是 (

A.铁片是原电池的正极
B.该装置能将电能转化为化学能
C.电子由铁片流出经过电流计流向碳棒
D.碳棒上的电极反应式为 $ Fe - 2 e^- \longequal{} Fe^{2+}$
C
)
A.铁片是原电池的正极
B.该装置能将电能转化为化学能
C.电子由铁片流出经过电流计流向碳棒
D.碳棒上的电极反应式为 $ Fe - 2 e^- \longequal{} Fe^{2+}$
答案:
3.C Fe能与CuSO₄反应生成FeSO₄和Cu,铁发生氧化反应,为原电池的负极,碳棒是正极,A错误;该装置为原电池,能将化学能转化为电能,B错误;在原电池中,电子从负极沿导线流入正极,故电子由铁片流出经过电流计流向碳棒,C正确;碳棒上Cu²⁺得电子被还原,电极反应式为Cu²⁺+2e⁻=Cu,D错误。
方法点津
原电池中正、负极的判断方法
(1)由组成原电池的电极材料判断。一般,较活泼的金属作负极。
(2)根据电流方向或电子移动方向判断。电子:负极→外电路→正极;电流:正极→外电路→负极。
(3)根据电解质溶液中离子移动方向判断。阴离子向负极迁移,阳离子向正极迁移。
(4)根据在电极上发生反应的物质得失电子判断。失电子发生氧化反应的是负极,得电子发生还原反应的是正极。
方法点津
原电池中正、负极的判断方法
(1)由组成原电池的电极材料判断。一般,较活泼的金属作负极。
(2)根据电流方向或电子移动方向判断。电子:负极→外电路→正极;电流:正极→外电路→负极。
(3)根据电解质溶液中离子移动方向判断。阴离子向负极迁移,阳离子向正极迁移。
(4)根据在电极上发生反应的物质得失电子判断。失电子发生氧化反应的是负极,得电子发生还原反应的是正极。
4.(2025 江苏普通高中学业水平合格性考试调研) 某科学探究小组为探究电化学原理, 设计了如图所示的装置。下列叙述不正确的是 (

A.a 和 b 不连接时, 铁片上有红色的铜析出
B.a 和 b 用导线连接时, 铜片为正极
C.无论 a 和 b 是否连接, 溶液中都有 $ Fe^{2+}$ 生成
D.a 和 b 用导线连接时, 溶液中的 $ Cu^{2+}$ 应向铁电极移动
D
)
A.a 和 b 不连接时, 铁片上有红色的铜析出
B.a 和 b 用导线连接时, 铜片为正极
C.无论 a 和 b 是否连接, 溶液中都有 $ Fe^{2+}$ 生成
D.a 和 b 用导线连接时, 溶液中的 $ Cu^{2+}$ 应向铁电极移动
答案:
4.D a和b不连接时,没有形成原电池,铁直接把铜置换出来,A正确;a和b用导线连接时,形成原电池,铁比铜活泼,铁片为负极,铜片为正极,B正确;无论a和b是否连接,铁片均会被氧化,溶液中均有Fe²⁺生成,C正确;a和b用导线连接时,形成原电池,铜电极为正极,阳离子向正极移动,D错误。
5.(2025 山东菏泽月考) 如图所示是 $ Zn$ 和 $ Cu$ 作电极形成的原电池, 某兴趣小组做完实验后, 在读书卡上的记录如下, 则卡片上的描述合理的是 (
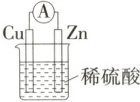
实验后的记录:
①$ Cu$ 为负极, $ Zn$ 为正极;
②$ Cu$ 电极上有气泡产生, 发生还原反应;
③$ SO_4^{2-}$ 向 $ Cu$ 电极移动;
④若有 $0.5\ mol$ 电子流经导线, 则可产生 $0.25\ mol$ 气体;
⑤电子的流向: $ Cu \longrightarrow$ 外电路 $\longrightarrow Zn$。
A.①②③
B.②④
C.②③④
D.③④⑤
B
)
实验后的记录:
①$ Cu$ 为负极, $ Zn$ 为正极;
②$ Cu$ 电极上有气泡产生, 发生还原反应;
③$ SO_4^{2-}$ 向 $ Cu$ 电极移动;
④若有 $0.5\ mol$ 电子流经导线, 则可产生 $0.25\ mol$ 气体;
⑤电子的流向: $ Cu \longrightarrow$ 外电路 $\longrightarrow Zn$。
A.①②③
B.②④
C.②③④
D.③④⑤
答案:
5.B 题给原电池中,Zn为负极,Cu为正极,①错误;铜电极上电极反应为2H⁺+2e⁻=H₂↑,发生还原反应,②正确;硫酸根离子向负极(锌)移动,③错误;若有0.5mol电子流经导线,则可产生气体的物质的量为$\frac{0.5mol}{2}=0.25mol,$④正确;电子由Zn电极经外电路流向Cu电极,⑤错误;B正确。
6.(2025 保定部分高中期中) 有 a、b、c、d 四种金属电极, 有关的实验装置及部分实验事实如下:
一般电池的活性物质贮存在电池内部, 而燃料电池的正、负极本身不包含活性物质, 因此燃料电池是把化学能转
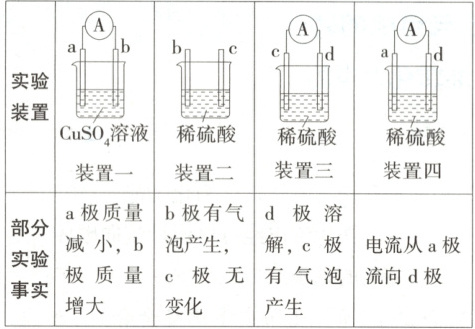
| 实验装置 | 装置一
$ CuSO_4$溶液 | 装置二
稀硫酸 | 装置三
稀硫酸 | 装置四
稀硫酸 |
| -- | -- | -- | -- | -- |
| 部分实验事实 | a 极质量减小, b 极质量增大 | b 极有气泡产生, c 极无变化 | d 极溶解, c 极有气泡产生 | 电流从 a 极流向 d 极 |
由此可判断这四种金属的活动性 (
A.a>b>c>d
B.b>c>d>a
C.d>a>b>c
D.a>b>d>c
一般电池的活性物质贮存在电池内部, 而燃料电池的正、负极本身不包含活性物质, 因此燃料电池是把化学能转

| 实验装置 | 装置一
$ CuSO_4$溶液 | 装置二
稀硫酸 | 装置三
稀硫酸 | 装置四
稀硫酸 |
| -- | -- | -- | -- | -- |
| 部分实验事实 | a 极质量减小, b 极质量增大 | b 极有气泡产生, c 极无变化 | d 极溶解, c 极有气泡产生 | 电流从 a 极流向 d 极 |
由此可判断这四种金属的活动性 (
C
)A.a>b>c>d
B.b>c>d>a
C.d>a>b>c
D.a>b>d>c
答案:
6.C
装置 分析 结论
装置一 形成原电池,a极质量减小,为负极;b极质量增大,为正极 金属的活动性:a>b
装置二 未形成原电池,b极有气泡产生,所以b极材料能与稀硫酸反应,c极无变化,所以c极材料不能与稀硫酸反应 金属的活动性:b>c
装置三 形成原电池,d极溶解为负极,c极有气泡产生为正极 金属的活动性:d>c
装置四 形成原电池,电流从a极流向d极,a极为正极,d极为负极 金属的活动性:d>a
综上分析可知,四种金属的活动性:d>a>b>c。
装置 分析 结论
装置一 形成原电池,a极质量减小,为负极;b极质量增大,为正极 金属的活动性:a>b
装置二 未形成原电池,b极有气泡产生,所以b极材料能与稀硫酸反应,c极无变化,所以c极材料不能与稀硫酸反应 金属的活动性:b>c
装置三 形成原电池,d极溶解为负极,c极有气泡产生为正极 金属的活动性:d>c
装置四 形成原电池,电流从a极流向d极,a极为正极,d极为负极 金属的活动性:d>a
综上分析可知,四种金属的活动性:d>a>b>c。
查看更多完整答案,请扫码查看


