2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
6.$◯$创新题|新情境 (2024 山东师范大学附中月考)
$\mathrm{Hg-Hg_2SO_4}$标准电极在生活中常用于测定其他电极的电势,测知$\mathrm{Hg-Hg_2SO_4}$电极的电势高于 Cu 电极的电势。以下说法正确的是(
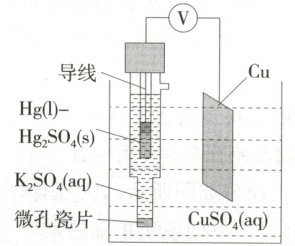
A.$\mathrm{K_2SO_4}$溶液可用$\mathrm{CCl_4}$代替
B.$\mathrm{Hg - Hg_2SO_4}$电极的电极反应式为$\mathrm{Hg_2SO_4−2e^− \xlongequal{ } 2Hg + SO_4^{2−}}$
C.微孔瓷片起到阻隔离子通过的作用
D.若把$\mathrm{Cu−CuSO_4}$体系换作$\mathrm{Zn−ZnSO_4}$体系,电压表的示数变大
$\mathrm{Hg-Hg_2SO_4}$标准电极在生活中常用于测定其他电极的电势,测知$\mathrm{Hg-Hg_2SO_4}$电极的电势高于 Cu 电极的电势。以下说法正确的是(
D
)
A.$\mathrm{K_2SO_4}$溶液可用$\mathrm{CCl_4}$代替
B.$\mathrm{Hg - Hg_2SO_4}$电极的电极反应式为$\mathrm{Hg_2SO_4−2e^− \xlongequal{ } 2Hg + SO_4^{2−}}$
C.微孔瓷片起到阻隔离子通过的作用
D.若把$\mathrm{Cu−CuSO_4}$体系换作$\mathrm{Zn−ZnSO_4}$体系,电压表的示数变大
答案:
6.D
信息提取 测知$ Hg- Hg_2 SO_4$电极的电势高于$ Cu$电极的电势
得出结论 $ Hg- Hg_2 SO_4$是正极,结合题图可知正极电极反应式为$ Hg_2 SO_4+2 e^-\longrightarrow 2 Hg+ SO_4^{2-}$,B项错误
$ CCl_4$不导电,则不能用$ CCl_4$代替$ K_2 SO_4$溶液,A项错误
分析选项 微孔瓷片能使离子通过,否则不能形成闭合回路,C项错误
$ Zn$比$ Cu$活泼,更容易失去电子,换作$ Zn- ZnSO_4$体系,电压表的示数变大,D项正确

6.D
信息提取 测知$ Hg- Hg_2 SO_4$电极的电势高于$ Cu$电极的电势
得出结论 $ Hg- Hg_2 SO_4$是正极,结合题图可知正极电极反应式为$ Hg_2 SO_4+2 e^-\longrightarrow 2 Hg+ SO_4^{2-}$,B项错误
$ CCl_4$不导电,则不能用$ CCl_4$代替$ K_2 SO_4$溶液,A项错误
分析选项 微孔瓷片能使离子通过,否则不能形成闭合回路,C项错误
$ Zn$比$ Cu$活泼,更容易失去电子,换作$ Zn- ZnSO_4$体系,电压表的示数变大,D项正确

7.2019 年诺贝尔化学奖授予了在锂离子电池研发领域做出贡献的三位科学家。一种锂离子电池的总反应式为$\mathrm{Li_xC_6 + Li_{1−x}CoO_2\xrightleftharpoons[充电]{放电} 6C + LiCoO_2}$,放电时其工作原理如图所示。下列说法不正确的是(
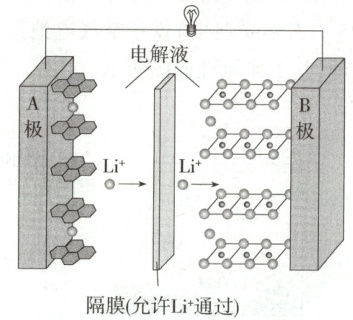
A.放电时, A 极电极反应式为$\mathrm{Li_xC_6−xe^− \xlongequal{ } 6C + xLi^+}$
B.放电时,若转移 0.3 mol 电子, A 极将增重 2.1 g
C.充电时, A 极接直流电源的负极
D.将该废旧电池进行“放电处理”,有利于锂在 B 极回收
B
)
A.放电时, A 极电极反应式为$\mathrm{Li_xC_6−xe^− \xlongequal{ } 6C + xLi^+}$
B.放电时,若转移 0.3 mol 电子, A 极将增重 2.1 g
C.充电时, A 极接直流电源的负极
D.将该废旧电池进行“放电处理”,有利于锂在 B 极回收
答案:
7.B 根据题图中$ Li^+$的移动方向可知,A极是负极,B极是正极。根据总反应可知,放电时,A极电极反应式为$ Li_x C_6-x e^-\longrightarrow 6 C+x Li^+$,A正确;放电时,若转移0.3mol电子,A极减少0.3mol$ Li$,A极将减轻$0.3×7 = 2.1$g,B错误;放电时,A极是负极,充电时,A极接直流电源的负极,C正确;放电过程中,$ Li^+$由A极向B极移动并在B极参与反应转化为$ LiCoO_2$,将该废旧电池进行“放电处理”,有利于锂在B极回收,D正确。
8.(2024 江苏盐城大丰高级中学月考)利用电化学原理可以设计出许多应用于环境保护、化学品提取的装置。
(1)将燃煤产生的二氧化碳回收利用,可达到降低碳排放的目的。下图是通过人工光合作用,以$\mathrm{CO_2}$和$\mathrm{H_2O}$为原料制备$\mathrm{HCOOH}$和$\mathrm{O_2}$的原理示意图。
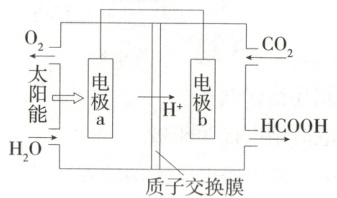
电极 b 作
(2)浓差电池可产生电动势是由于电池中存在浓度差。某浓差电池的原理如图所示,该电池从浓缩海水中提取$\mathrm{LiCl}$的同时又获得了电能。
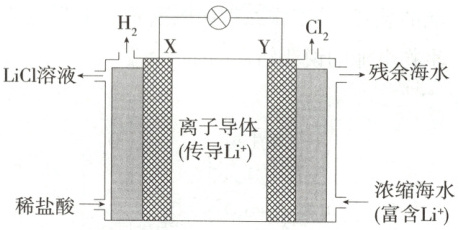
①Y 电极反应式为
②Y 极生成 1 mol$\mathrm{Cl_2}$时,
]
(1)将燃煤产生的二氧化碳回收利用,可达到降低碳排放的目的。下图是通过人工光合作用,以$\mathrm{CO_2}$和$\mathrm{H_2O}$为原料制备$\mathrm{HCOOH}$和$\mathrm{O_2}$的原理示意图。

电极 b 作
正
极,电极反应式为$ CO_2+2 e^-+2 H^+\longrightarrow HCOOH$
。(2)浓差电池可产生电动势是由于电池中存在浓度差。某浓差电池的原理如图所示,该电池从浓缩海水中提取$\mathrm{LiCl}$的同时又获得了电能。

①Y 电极反应式为
$2 Cl^--2 e^-\longrightarrow Cl_2\uparrow$
。②Y 极生成 1 mol$\mathrm{Cl_2}$时,
2
mol$\mathrm{Li^+}$移向X
(填“X”或“Y”)极。]
答案:
8.答案
(1)正 $ CO_2+2 e^-+2 H^+\longrightarrow HCOOH$
(2)①$2 Cl^--2 e^-\longrightarrow Cl_2\uparrow$ ②2 X
解析
(1)图示为原电池装置,$ CO_2$在电极b附近转化为$ HCOOH$,发生还原反应,即电极b作正极,电极反应式为$ CO_2+2 e^-+2 H^+\longrightarrow HCOOH$。
(2)①据图可知,$ H^+$在电极X上转化为$ H_2$,发生还原反应,则X为正极;Y为负极,$ Cl^-$在负极发生氧化反应生成$ Cl_2$,电极反应式为$2 Cl^--2 e^-\longrightarrow Cl_2\uparrow$。②由Y极反应式可知,生成1mol$ Cl_2$时,转移2mol电子,则有2mol$ Li^+$移向正极,即移向X极。
(1)正 $ CO_2+2 e^-+2 H^+\longrightarrow HCOOH$
(2)①$2 Cl^--2 e^-\longrightarrow Cl_2\uparrow$ ②2 X
解析
(1)图示为原电池装置,$ CO_2$在电极b附近转化为$ HCOOH$,发生还原反应,即电极b作正极,电极反应式为$ CO_2+2 e^-+2 H^+\longrightarrow HCOOH$。
(2)①据图可知,$ H^+$在电极X上转化为$ H_2$,发生还原反应,则X为正极;Y为负极,$ Cl^-$在负极发生氧化反应生成$ Cl_2$,电极反应式为$2 Cl^--2 e^-\longrightarrow Cl_2\uparrow$。②由Y极反应式可知,生成1mol$ Cl_2$时,转移2mol电子,则有2mol$ Li^+$移向正极,即移向X极。
查看更多完整答案,请扫码查看


