2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第13页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
6. 部分共价键的键能见下表:
| 共价键 | H—H | N≡N | N—H |
|--------|-----|-----|-----|
| 键能/(kJ·mol⁻¹) | 436 | 946 | 391 |
(1) 若 1 mol N₂(g) 与 3 mol H₂(g) 完全反应生成 2 mol NH₃(g),
(2) 事实上, 将 1 mol N₂(g) 和 3 mol H₂(g) 放在反应容器中, 使它们充分反应, 反应的热量变化值总小于计算值, 原因是
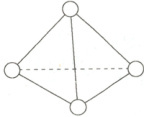
(3) 如图所示, N₄ 分子结构与白磷分子结构相似, 为正四面体形。已知断裂 1 mol N—N 键吸收 193 kJ 热量, 则 1 mol N₄(g) 完全转化为 N₂(g) 时要
| 共价键 | H—H | N≡N | N—H |
|--------|-----|-----|-----|
| 键能/(kJ·mol⁻¹) | 436 | 946 | 391 |
(1) 若 1 mol N₂(g) 与 3 mol H₂(g) 完全反应生成 2 mol NH₃(g),
放出
(填“吸收”或“放出”) 92
kJ 能量。(2) 事实上, 将 1 mol N₂(g) 和 3 mol H₂(g) 放在反应容器中, 使它们充分反应, 反应的热量变化值总小于计算值, 原因是
该反应是可逆反应,不能完全反应
。(3) 如图所示, N₄ 分子结构与白磷分子结构相似, 为正四面体形。已知断裂 1 mol N—N 键吸收 193 kJ 热量, 则 1 mol N₄(g) 完全转化为 N₂(g) 时要
放出
(填“吸收”或“放出”) 734
kJ 热量。
答案:
6.答案
(1)放出 92
(2)该反应是可逆反应,不能完全反应
(3)放出 734
解析
(1)N₂(g)+3H₂(g)=2NH₃(g) ΔH,ΔH=(946+3×436-6×391) kJ·mol⁻¹ = -92 kJ·mol⁻¹,若1 mol N₂(g)与3 mol H₂(g)完全反应生成2 mol NH₃(g),放出92 kJ能量。
(3)N₄(g)=2N₂(g) ΔH,ΔH=6×193 kJ·mol⁻¹-2×946 kJ·mol⁻¹ = -734 kJ·mol⁻¹,该反应为放热反应,1 mol N₄(g)完全转化为N₂(g)时放出734 kJ热量。
(1)放出 92
(2)该反应是可逆反应,不能完全反应
(3)放出 734
解析
(1)N₂(g)+3H₂(g)=2NH₃(g) ΔH,ΔH=(946+3×436-6×391) kJ·mol⁻¹ = -92 kJ·mol⁻¹,若1 mol N₂(g)与3 mol H₂(g)完全反应生成2 mol NH₃(g),放出92 kJ能量。
(3)N₄(g)=2N₂(g) ΔH,ΔH=6×193 kJ·mol⁻¹-2×946 kJ·mol⁻¹ = -734 kJ·mol⁻¹,该反应为放热反应,1 mol N₄(g)完全转化为N₂(g)时放出734 kJ热量。
7. (2024 浙江湖州二中月考) 根据如下能量关系示意图进行判断, 下列说法正确的是 (

A.1 mol C(s) 与 1 mol O₂(g) 的能量之和为 393.5 kJ
B.CO(g) 比 CO₂(g) 的能量高
C.C(s) 燃烧生成 CO(g) 的热化学方程式为 C(s) + $\frac{1}{2}$O₂(g) = CO(g) ΔH = 1106 kJ·mol⁻¹
D.CO 气体燃烧的热化学方程式为 2CO(g) + O₂(g) = 2CO₂(g) ΔH = -565.8 kJ·mol⁻¹
D
)
A.1 mol C(s) 与 1 mol O₂(g) 的能量之和为 393.5 kJ
B.CO(g) 比 CO₂(g) 的能量高
C.C(s) 燃烧生成 CO(g) 的热化学方程式为 C(s) + $\frac{1}{2}$O₂(g) = CO(g) ΔH = 1106 kJ·mol⁻¹
D.CO 气体燃烧的热化学方程式为 2CO(g) + O₂(g) = 2CO₂(g) ΔH = -565.8 kJ·mol⁻¹
答案:
7.D 由题图可知:1 mol C(s)与1 mol O₂(g)完全反应生成1 mol CO₂(g)放热393.5 kJ,生成物CO₂的能量不为0,故1 mol C(s)与1 mol O₂(g)能量之和大于393.5 kJ,A错误;CO燃烧放热,说明1 mol CO(g)与0.5 mol O₂(g)的总能量大于1 mol CO₂(g)的能量,不能说明CO(g)的能量比CO₂(g)高,B错误;C燃烧生成CO为放热反应,其ΔH<0,C错误;结合图示可写出CO气体燃烧的热化学方程式为2CO(g)+O₂(g)=2CO₂(g) ΔH = -565.8 kJ·mol⁻¹,D正确。
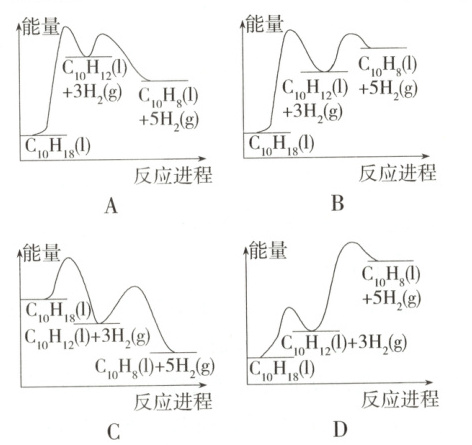
8. (2025 安徽阜阳月考) 已知:
Ⅰ. C₁₀H₁₈(l) = C₁₀H₁₂(l) + 3H₂(g) ΔH₁;
Ⅱ. C₁₀H₁₂(l) = C₁₀H₈(l) + 2H₂(g) ΔH₂。
若同温同压下, ΔH₂ > ΔH₁ > 0。下列示意图正确的是 (
]
Ⅰ. C₁₀H₁₈(l) = C₁₀H₁₂(l) + 3H₂(g) ΔH₁;
Ⅱ. C₁₀H₁₂(l) = C₁₀H₈(l) + 2H₂(g) ΔH₂。
若同温同压下, ΔH₂ > ΔH₁ > 0。下列示意图正确的是 (
D
)
]
答案:
8.D 由ΔH₂>ΔH₁>0可知,反应Ⅰ、Ⅱ均为吸热反应。A项图示中反应Ⅱ为放热反应,错误;B项图示中ΔH₁>ΔH₂,错误;C项图示中反应Ⅰ、Ⅱ均为放热反应,错误;D项图示中反应Ⅰ、Ⅱ均为吸热反应,且ΔH₂>ΔH₁,正确。故选D。
9. (2024 湖南长沙统考) 写出下列反应的热化学方程式。
(1) 将 1 g H₂ 在 Cl₂ 中完全燃烧, 放出 92.4 kJ 热量:
(2) 充分燃烧 a g C₂H₂(g) 时生成 1 mol CO₂(g) 和 0.5 mol H₂O(l), 放出 b kJ 热量:
(3) 1 g 碳单质与适量水蒸气反应生成 CO 和 H₂, 吸收 10.94 kJ 的热量:
(4) 热值指一定条件下单位质量的物质完全燃烧所放出的热量, CH₄(g) 的热值为 55.625 kJ·g⁻¹, 则 CH₄(g) 完全燃烧生成 CO₂(g) 和 H₂O(l) 的热化学方程式为:
热值是指一定条件下单位质量的可燃物完全燃烧所放出的热。
(1) 将 1 g H₂ 在 Cl₂ 中完全燃烧, 放出 92.4 kJ 热量:
$\frac{1}{2}$H₂(g)+$\frac{1}{2}$Cl₂(g)=HCl(g) ΔH = -92.4 kJ·mol⁻¹
。(2) 充分燃烧 a g C₂H₂(g) 时生成 1 mol CO₂(g) 和 0.5 mol H₂O(l), 放出 b kJ 热量:
2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l) ΔH = -4b kJ·mol⁻¹
。(3) 1 g 碳单质与适量水蒸气反应生成 CO 和 H₂, 吸收 10.94 kJ 的热量:
C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = +131.28 kJ·mol⁻¹
。(4) 热值指一定条件下单位质量的物质完全燃烧所放出的热量, CH₄(g) 的热值为 55.625 kJ·g⁻¹, 则 CH₄(g) 完全燃烧生成 CO₂(g) 和 H₂O(l) 的热化学方程式为:
CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH = -890 kJ·mol⁻¹
。热值是指一定条件下单位质量的可燃物完全燃烧所放出的热。
答案:
9.答案
(1)$\frac{1}{2}$H₂(g)+$\frac{1}{2}$Cl₂(g)=HCl(g) ΔH = -92.4 kJ·mol⁻¹
(2)2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l) ΔH = -4b kJ·mol⁻¹
(3)C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = +131.28 kJ·mol⁻¹
(4)CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH = -890 kJ·mol⁻¹
解析
(1)将1 g(0.5 mol)H₂在Cl₂中完全燃烧,放出92.4 kJ热量,则$\frac{1}{2}$H₂(g)+$\frac{1}{2}$Cl₂(g)=HCl(g) ΔH = -92.4 kJ·mol⁻¹。
(2)解题导引:

第一步:写对应化学方程式 2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l)
第二步:分析题干信息 a g C₂H₂(g)燃烧→1 mol CO₂(g)+0.5 mol H₂O(l)放出b kJ热量
第三步:求算 2 mol C₂H₂(g)燃烧→4 mol CO₂(g)+2 mol H₂O(l)放出4b kJ热量
则热化学方程式为2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l) ΔH = -4b kJ·mol⁻¹。
(3)解题导引:

第一步:写对应化学方程式 C(s)+H₂O(g)=CO(g)+H₂(g)
第二步:分析题干信息 1g碳单质与适量H₂O(g)反应生成CO和H₂,吸收10.94k热量
第三步:求算 12g(1mol)碳单质完全反应需吸收12×10.94k=131.28k热量
则热化学方程式为C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = +131.28 kJ·mol⁻¹。
(4)解题导引:

第一步:写对应化学方程式 CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l)
第二步:分析题干信息 CH₄(g)的热值为55.625 kJ·g⁻¹
第三步:求算 1 mol (16g)CH₄(g)完全燃烧放热16g×55.625 kJ·g⁻¹=890 kJ
则热化学方程式为CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH = -890 kJ·mol⁻¹。
方法点津
书写热化学方程式的“五步骤”

一写方程式——写出配平的化学方程式
二标状态——用s、l、g、aq标明物质的聚集状态
三标条件——标明反应的温度和压强(25 ℃、101 kPa时可不标注)
四标ΔH——在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”
五标数值——根据化学计量数计算出ΔH的数值
9.答案
(1)$\frac{1}{2}$H₂(g)+$\frac{1}{2}$Cl₂(g)=HCl(g) ΔH = -92.4 kJ·mol⁻¹
(2)2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l) ΔH = -4b kJ·mol⁻¹
(3)C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = +131.28 kJ·mol⁻¹
(4)CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH = -890 kJ·mol⁻¹
解析
(1)将1 g(0.5 mol)H₂在Cl₂中完全燃烧,放出92.4 kJ热量,则$\frac{1}{2}$H₂(g)+$\frac{1}{2}$Cl₂(g)=HCl(g) ΔH = -92.4 kJ·mol⁻¹。
(2)解题导引:

第一步:写对应化学方程式 2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l)
第二步:分析题干信息 a g C₂H₂(g)燃烧→1 mol CO₂(g)+0.5 mol H₂O(l)放出b kJ热量
第三步:求算 2 mol C₂H₂(g)燃烧→4 mol CO₂(g)+2 mol H₂O(l)放出4b kJ热量
则热化学方程式为2C₂H₂(g)+5O₂(g)=4CO₂(g)+2H₂O(l) ΔH = -4b kJ·mol⁻¹。
(3)解题导引:

第一步:写对应化学方程式 C(s)+H₂O(g)=CO(g)+H₂(g)
第二步:分析题干信息 1g碳单质与适量H₂O(g)反应生成CO和H₂,吸收10.94k热量
第三步:求算 12g(1mol)碳单质完全反应需吸收12×10.94k=131.28k热量
则热化学方程式为C(s)+H₂O(g)=CO(g)+H₂(g) ΔH = +131.28 kJ·mol⁻¹。
(4)解题导引:

第一步:写对应化学方程式 CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l)
第二步:分析题干信息 CH₄(g)的热值为55.625 kJ·g⁻¹
第三步:求算 1 mol (16g)CH₄(g)完全燃烧放热16g×55.625 kJ·g⁻¹=890 kJ
则热化学方程式为CH₄(g)+2O₂(g)=CO₂(g)+2H₂O(l) ΔH = -890 kJ·mol⁻¹。
方法点津
书写热化学方程式的“五步骤”

一写方程式——写出配平的化学方程式
二标状态——用s、l、g、aq标明物质的聚集状态
三标条件——标明反应的温度和压强(25 ℃、101 kPa时可不标注)
四标ΔH——在方程式后写出ΔH,并根据信息注明ΔH的“+”或“-”
五标数值——根据化学计量数计算出ΔH的数值
查看更多完整答案,请扫码查看


