2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第18页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
6.(2024 江苏扬州邗江中学期中)肼$( N_2 H_4) $—空气燃料电池是一种碱性燃料电池,电解质溶液是$20\% \sim 30\% $的$ KOH $溶液。下列说法中正确的是 (
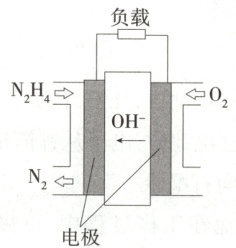
A.该电池放电时,通入$ O_2 $的一极为负极
B.电池每释放$1 mol N_2 $转移的电子数为$6 mol $
C.电池工作一段时间后,电解质溶液中$ c( OH^-) $不变
D.正极的电极反应式是$ O_2 + 2 H_2 O + 4 e^- = 4 OH^- $
D
)
A.该电池放电时,通入$ O_2 $的一极为负极
B.电池每释放$1 mol N_2 $转移的电子数为$6 mol $
C.电池工作一段时间后,电解质溶液中$ c( OH^-) $不变
D.正极的电极反应式是$ O_2 + 2 H_2 O + 4 e^- = 4 OH^- $
答案:
6.D 该燃料电池工作时,通入肼的电极是负极,通入O₂的电极是正极,A错误;结合负极反应式N₂H₄-4e⁻+4OH⁻=N₂+4H₂O,可知电池每释放1molN₂转移的电子数为4mol,B错误;电池正极反应式为O₂+2H₂O+4e⁻=4OH⁻,由正、负极反应式可知,电池工作一段时间后,由于水的生成,电解质溶液中c(OH⁻)减小,C错误,D正确。
7.(2025 江苏南京阶段检测)Ⅰ.氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
(1)a电极的电极反应式是
(2)一段时间后,需向装置中补充$ KOH $,请依据反应原理解释原因:
Ⅱ.某燃料电池中,稀硫酸作电解质溶液,向其中一个电极通入甲醇$( CH_3 OH) $,同时向另一个电极通入空气,此电池的正极反应式为
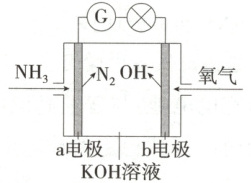
(1)a电极的电极反应式是
2NH₃-6e⁻+6OH⁻=N₂+6H₂O
。(2)一段时间后,需向装置中补充$ KOH $,请依据反应原理解释原因:
电池总反应为4NH₃+3O₂=2N₂+6H₂O,有水生成,使得电解质溶液逐渐变稀,一段时间后需要补充KOH
。Ⅱ.某燃料电池中,稀硫酸作电解质溶液,向其中一个电极通入甲醇$( CH_3 OH) $,同时向另一个电极通入空气,此电池的正极反应式为
O₂+4e⁻+4H⁺=2H₂O
。
答案:
7.答案Ⅰ.
(1)2NH₃-6e⁻+6OH⁻=N₂+6H₂O
(2)电池总反应为4NH₃+3O₂=2N₂+6H₂O,有水生成,使得电解质溶液逐渐变稀,一段时间后需要补充KOH
Ⅱ.O₂+4e⁻+4H⁺=2H₂O
解析Ⅰ.
(1)a电极通入的是NH₃,NH₃失去电子发生氧化反应,a电极作负极,电极反应式是2NH₃-6e⁻+6OH⁻=N₂+6H₂O。
(2)一段时间后,向装置中补充KOH,原因是电池总反应为4NH₃+3O₂=2N₂+6H₂O,有水生成,使得电解质溶液逐渐变稀,一段时间后需要补充KOH。
Ⅱ.该燃料电池中通入甲醇的电极为负极,正极通入的O₂在酸性条件下被还原生成H₂O,电极反应式为O₂+4e⁻+4H⁺=2H₂O。
名师点睛
解答燃料电池题目的三个关键点
(1)要注意介质是什么,是电解质溶液、熔融电解质还是固体氧化物。
(2)通入负极的物质是燃料,失去电子;通入正极的物质一般是氧气,得到电子。
(3)通过介质中离子的移动方向可判断电池的正、负极,阳离子移向正极,阴离子移向负极;同时要考虑介质中离子是否参与电极反应。
(1)2NH₃-6e⁻+6OH⁻=N₂+6H₂O
(2)电池总反应为4NH₃+3O₂=2N₂+6H₂O,有水生成,使得电解质溶液逐渐变稀,一段时间后需要补充KOH
Ⅱ.O₂+4e⁻+4H⁺=2H₂O
解析Ⅰ.
(1)a电极通入的是NH₃,NH₃失去电子发生氧化反应,a电极作负极,电极反应式是2NH₃-6e⁻+6OH⁻=N₂+6H₂O。
(2)一段时间后,向装置中补充KOH,原因是电池总反应为4NH₃+3O₂=2N₂+6H₂O,有水生成,使得电解质溶液逐渐变稀,一段时间后需要补充KOH。
Ⅱ.该燃料电池中通入甲醇的电极为负极,正极通入的O₂在酸性条件下被还原生成H₂O,电极反应式为O₂+4e⁻+4H⁺=2H₂O。
名师点睛
解答燃料电池题目的三个关键点
(1)要注意介质是什么,是电解质溶液、熔融电解质还是固体氧化物。
(2)通入负极的物质是燃料,失去电子;通入正极的物质一般是氧气,得到电子。
(3)通过介质中离子的移动方向可判断电池的正、负极,阳离子移向正极,阴离子移向负极;同时要考虑介质中离子是否参与电极反应。
8.(2025 河南南阳第一中学月考)如图所示是电解$ CuCl_2 $溶液的装置,其中c、d为石墨电极。下列有关判断正确的是 (
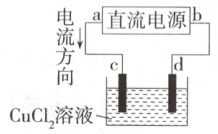
A.a 为负极,b 为正极
B.a 为阳极,b 为阴极
C.电解过程中,d 电极质量增加
D.电解过程中,溶液中氯离子浓度不变
C
)
A.a 为负极,b 为正极
B.a 为阳极,b 为阴极
C.电解过程中,d 电极质量增加
D.电解过程中,溶液中氯离子浓度不变
答案:
8.C 电流从直流电源的正极流出,因此a为电源正极,b为电源负极,c为阳极,d为阴极;电解CuCl₂溶液,阳极(c电极)的电极反应式为2Cl⁻-2e⁻=Cl₂↑,阴极(d电极)的电极反应式为Cu²⁺+2e⁻=Cu,故C项正确。
9.(2025 河北石家庄段考)如下图所示,A、B 两个装置的烧杯中分别盛有足量的$ CuSO_4 $溶液。
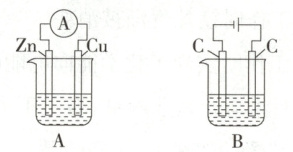
(1)A、B两个装置中属于原电池的是
(2)A 中 Zn 是
(3)B 中左边 C 是

(1)A、B两个装置中属于原电池的是
A
(填字母,下同),属于电解池的是B
。(2)A 中 Zn 是
负
极,发生氧化
(填“氧化”或“还原”)反应,电极反应式为Zn-2e⁻=Zn²⁺
;Cu 电极的电极反应式为Cu²⁺+2e⁻=Cu
;A中总反应的离子方程式为Zn+Cu²⁺=Zn²⁺+Cu
。(3)B 中左边 C 是
阴
极,发生还原
(填“氧化”或“还原”)反应,电极反应式为Cu²⁺+2e⁻=Cu
;B中总反应的化学方程式为$2CuSO₄+2H₂O\xlongequal{通电}2Cu+2H₂SO₄+O₂↑$
。
答案:
9.答案
(1)A B
(2)负 氧化 Zn-2e⁻=Zn²⁺ Cu²⁺+2e⁻=Cu Zn+Cu²⁺=Zn²⁺+Cu
(3)阴 还原$ Cu²⁺+2e⁻=Cu 2CuSO₄+2H₂O\xlongequal{通电}2Cu+2H₂SO₄+O₂↑$
解析
(1)电解池有外接电源而原电池没有,B属于电解池,A属于原电池。
(2)锌比铜活泼,Zn是负极,发生氧化反应,电极反应式为Zn-2e⁻=Zn²⁺;Cu为正极,电极反应式为Cu²⁺+2e⁻=Cu;A中总反应的离子方程式为Zn+Cu²⁺=Zn²⁺+Cu。
(3)B是电解池,左边C和电源负极相连,是阴极,发生还原反应,电极反应式为Cu²⁺+2e⁻=Cu;B中总反应的化学方程式为$2CuSO₄+2H₂O\xlongequal{通电}2Cu+2H₂SO₄+O₂↑。$
(1)A B
(2)负 氧化 Zn-2e⁻=Zn²⁺ Cu²⁺+2e⁻=Cu Zn+Cu²⁺=Zn²⁺+Cu
(3)阴 还原$ Cu²⁺+2e⁻=Cu 2CuSO₄+2H₂O\xlongequal{通电}2Cu+2H₂SO₄+O₂↑$
解析
(1)电解池有外接电源而原电池没有,B属于电解池,A属于原电池。
(2)锌比铜活泼,Zn是负极,发生氧化反应,电极反应式为Zn-2e⁻=Zn²⁺;Cu为正极,电极反应式为Cu²⁺+2e⁻=Cu;A中总反应的离子方程式为Zn+Cu²⁺=Zn²⁺+Cu。
(3)B是电解池,左边C和电源负极相连,是阴极,发生还原反应,电极反应式为Cu²⁺+2e⁻=Cu;B中总反应的化学方程式为$2CuSO₄+2H₂O\xlongequal{通电}2Cu+2H₂SO₄+O₂↑。$
查看更多完整答案,请扫码查看


