2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
4. (2025 河北保定部分高中期中)某兴趣小组设计用铁粉将$NO$还原为${N_{2}}$(同时生成$FeO$),下列说法不正确的是 (

| | |
| ---- | ---- |
|甲||
|乙||
|丙||
|丁||
|戊||
|己||
已知:①浓硝酸可氧化$NO$。②$NaOH$溶液能吸收${NO_{2}}$,不吸收$NO$。
A.接口的连接顺序为$a\to f\to e\to j\to i\to h\to g$(或$g\to h$)$\to b\to c\to d$
B.装置戊中发生反应的化学方程式:${2NO + 2Fe\xlongequal{\triangle} 2FeO + N_{2}}$
C.装置丁的作用是除去挥发出来的硝酸和产生的${NO_{2}}$
D.装置乙的作用是干燥气体,防止水蒸气进入戊中干扰反应
D
)
| | |
| ---- | ---- |
|甲||
|乙||
|丙||
|丁||
|戊||
|己||
已知:①浓硝酸可氧化$NO$。②$NaOH$溶液能吸收${NO_{2}}$,不吸收$NO$。
A.接口的连接顺序为$a\to f\to e\to j\to i\to h\to g$(或$g\to h$)$\to b\to c\to d$
B.装置戊中发生反应的化学方程式:${2NO + 2Fe\xlongequal{\triangle} 2FeO + N_{2}}$
C.装置丁的作用是除去挥发出来的硝酸和产生的${NO_{2}}$
D.装置乙的作用是干燥气体,防止水蒸气进入戊中干扰反应
答案:
4.D 题给实验用NO与铁粉反应生成N₂和FeO,甲装置制备NO气体,制备的NO气体中混有水蒸气、硝酸蒸气和NO₂,水蒸气用P₂O₅除去,NO₂和硝酸蒸气用水除去,NO有毒,需要进行尾气处理,根据信息,先通过浓硝酸将NO氧化为NO₂,再通入NaOH溶液中除去。接口连接顺序是a→f→e→j→i→h→g(或g→h)→b→c→d,A正确;NO与铁粉反应生成氮气和FeO,其化学方程式为2NO+2Fe$\xlongequal{△}$2FeO+N₂,B正确;装置丁的作用是除去挥发出来的硝酸和产生的NO₂,C正确;浓硝酸不具有吸水性,不能做干燥剂,根据信息可知,浓硝酸的作用是将NO氧化成NO₂,便于NaOH溶液吸收,防止污染环境,D错误。
5. 创新题 (2024 江西五市九校联考)回答下列问题:
(1) 金属与硝酸反应通常不能生成${H_{2}}$,用过量${3\ \mathrm{mol· L^{-1}}\ HNO_{3}}$与铁粉反应,${HNO_{3}}$的还原产物主要是$NO$,请写出反应的离子方程式:
有同学在查阅文献时发现文献有记载:${HNO_{3}}$与铁反应能产生${H_{2}}$。于是该同学进行了金属铁与硝酸反应能否产生${H_{2}}$及其有利条件的探究。
实验Ⅰ:${20\ ^{\circ}\mathrm{C}}$,将过量铁粉溶于${0.5\ \mathrm{mol· L^{-1}}\ HNO_{3}}$中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2) 检验气体:方法如图所示。
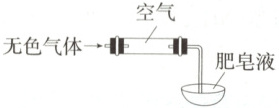
经确认气体是${H_{2}}$,不含$NO$。实验证据是
(3) 检验溶液:取上层清液,等分为两份。
①向一份溶液中滴加${K_{3}[Fe(CN)_{6}]}$溶液,产生
②向另一份溶液中加入$NaOH$溶液,产生灰绿色沉淀;加热至沸腾,逸出有刺激性气味的气体,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有${Fe + 2HNO_{3}\xlongequal{} Fe(NO_{3})_{2} + H_{2}\uparrow}$,还有
对${H_{2}}$产生的原因提出假设:在稀的硝酸溶液中,${H^{+}}$的氧化性强于${NO^{-}_{3}}$,验证如下:
(4) 实验Ⅱ:将铜粉溶于${0.5\ \mathrm{mol· L^{-1}}\ HNO_{3}}$中,经检测,发现没有
(5) 再次查阅文献发现:在酸性介质中,尽管电极电势数据显示${NO^{-}_{3}}$是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是该同学改变条件重复实验Ⅰ,向${2\ \mathrm{mL}\ 0.5\ \mathrm{mol· L^{-1}}\ HNO_{3}}$中加入过量铁粉,结果如下:
|实验序号|Ⅲ|Ⅳ|Ⅴ|
| ---- | ---- | ---- | ---- |
|温度|${20\ ^{\circ}\mathrm{C}}$|${40\ ^{\circ}\mathrm{C}}$|${60\ ^{\circ}\mathrm{C}}$|
|生成${H_{2}}$体积|${6.0\ \mathrm{mL}}$|${3.4\ \mathrm{mL}}$|${2.6\ \mathrm{mL}}$|
经检验,实验Ⅲ、Ⅳ、Ⅴ中,${NO^{-}_{3}}$的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高${H_{2}}$体积减小的原因:
(6) 综上所述,有利于金属与硝酸反应生成氢气的条件是
(1) 金属与硝酸反应通常不能生成${H_{2}}$,用过量${3\ \mathrm{mol· L^{-1}}\ HNO_{3}}$与铁粉反应,${HNO_{3}}$的还原产物主要是$NO$,请写出反应的离子方程式:
Fe+4H⁺+NO₃⁻=Fe³⁺+NO↑+2H₂O
。有同学在查阅文献时发现文献有记载:${HNO_{3}}$与铁反应能产生${H_{2}}$。于是该同学进行了金属铁与硝酸反应能否产生${H_{2}}$及其有利条件的探究。
实验Ⅰ:${20\ ^{\circ}\mathrm{C}}$,将过量铁粉溶于${0.5\ \mathrm{mol· L^{-1}}\ HNO_{3}}$中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2) 检验气体:方法如图所示。

经确认气体是${H_{2}}$,不含$NO$。实验证据是
气体遇空气未见红棕色,点燃肥皂泡,发出爆鸣声
。(3) 检验溶液:取上层清液,等分为两份。
①向一份溶液中滴加${K_{3}[Fe(CN)_{6}]}$溶液,产生
蓝色沉淀
,说明含有${Fe^{2+}}$。②向另一份溶液中加入$NaOH$溶液,产生灰绿色沉淀;加热至沸腾,逸出有刺激性气味的气体,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有${Fe + 2HNO_{3}\xlongequal{} Fe(NO_{3})_{2} + H_{2}\uparrow}$,还有
4Fe+10HNO₃=4Fe(NO₃)₂+NH₄NO₃+3H₂O
(写出化学方程式)。对${H_{2}}$产生的原因提出假设:在稀的硝酸溶液中,${H^{+}}$的氧化性强于${NO^{-}_{3}}$,验证如下:
(4) 实验Ⅱ:将铜粉溶于${0.5\ \mathrm{mol· L^{-1}}\ HNO_{3}}$中,经检测,发现没有
H₂
(填化学式)生成,初步证实假设不成立。(5) 再次查阅文献发现:在酸性介质中,尽管电极电势数据显示${NO^{-}_{3}}$是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是该同学改变条件重复实验Ⅰ,向${2\ \mathrm{mL}\ 0.5\ \mathrm{mol· L^{-1}}\ HNO_{3}}$中加入过量铁粉,结果如下:
|实验序号|Ⅲ|Ⅳ|Ⅴ|
| ---- | ---- | ---- | ---- |
|温度|${20\ ^{\circ}\mathrm{C}}$|${40\ ^{\circ}\mathrm{C}}$|${60\ ^{\circ}\mathrm{C}}$|
|生成${H_{2}}$体积|${6.0\ \mathrm{mL}}$|${3.4\ \mathrm{mL}}$|${2.6\ \mathrm{mL}}$|
经检验,实验Ⅲ、Ⅳ、Ⅴ中,${NO^{-}_{3}}$的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高${H_{2}}$体积减小的原因:
温度升高,H⁺、NO₃⁻被还原的速率均增大,NO₃⁻被还原的速率增大得更多;NO₃⁻被还原时H⁺同时被消耗,H⁺得电子机会减少,导致产生的H₂体积减小
。(6) 综上所述,有利于金属与硝酸反应生成氢气的条件是
较低温度、低浓度硝酸
。
答案:
5.答案
(1)Fe+4H⁺+NO₃⁻=Fe³⁺+NO↑+2H₂O
(2)气体遇空气未见红棕色,点燃肥皂泡,发出爆鸣声
(3)①蓝色沉淀 ②4Fe+10HNO₃=4Fe(NO₃)₂+NH₄NO₃+3H₂O
(4)H₂
(5)温度升高,H⁺、NO₃⁻被还原的速率均增大,NO₃⁻被还原的速率增大得更多;NO₃⁻被还原时H⁺同时被消耗,H⁺得电子机会减少,导致产生的H₂体积减小
(6)较低温度、低浓度硝酸
(1)Fe+4H⁺+NO₃⁻=Fe³⁺+NO↑+2H₂O
(2)气体遇空气未见红棕色,点燃肥皂泡,发出爆鸣声
(3)①蓝色沉淀 ②4Fe+10HNO₃=4Fe(NO₃)₂+NH₄NO₃+3H₂O
(4)H₂
(5)温度升高,H⁺、NO₃⁻被还原的速率均增大,NO₃⁻被还原的速率增大得更多;NO₃⁻被还原时H⁺同时被消耗,H⁺得电子机会减少,导致产生的H₂体积减小
(6)较低温度、低浓度硝酸
查看更多完整答案,请扫码查看


