2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
6.(2024广东华南师范大学附属中学期中)氨催化氧化法是工业生产中制取硝酸的重要途径,某同学用该原理设计实验制备硝酸并探究硝酸的性质,装置如图所示(装置内空气均已排尽)。下列说法错误的是 (
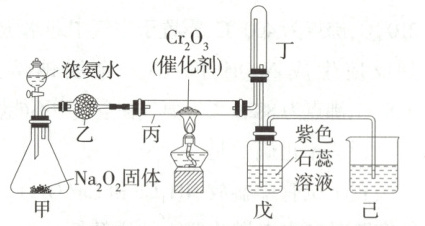
A.若装置戊中紫色石蕊溶液变红,则说明已制得硝酸
B.理论上装置丙中通入的氨气和氧气物质的量之比为1∶2时可以完全被吸收生成$\mathrm{HNO_3}$
C.甲装置中的固体不能为NaOH或CaO
D.装置乙中的干燥剂可以为无水氯化钙
D
)
A.若装置戊中紫色石蕊溶液变红,则说明已制得硝酸
B.理论上装置丙中通入的氨气和氧气物质的量之比为1∶2时可以完全被吸收生成$\mathrm{HNO_3}$
C.甲装置中的固体不能为NaOH或CaO
D.装置乙中的干燥剂可以为无水氯化钙
答案:
6.D
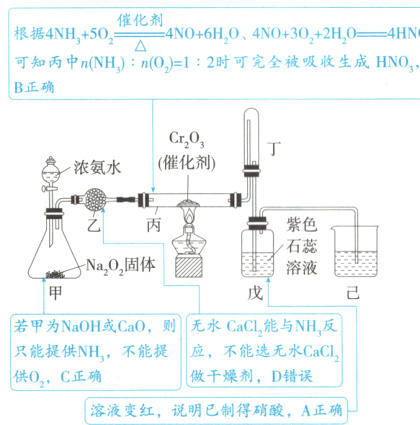
根据$ 4NH₃ + 5O₂\stackrel{催化剂}{\underset{\triangle}{=}}4NO + 6H₂O、$4NO + 3O₂ + 2H₂O = 4HNO₃,可知丙中 n(NH₃) : n(O₂) = 1 : 2 时可完全被吸收生成 HNO₃,B 正确;若甲为 NaOH 或 CaO,则只能提供 NH₃,不能提供 O₂,C 正确;无水 CaCl₂能与 NH₃反应,不能选无水 CaCl₂做干燥剂,D 错误;溶液变红,说明已制得硝酸,A 正确。
6.D

根据$ 4NH₃ + 5O₂\stackrel{催化剂}{\underset{\triangle}{=}}4NO + 6H₂O、$4NO + 3O₂ + 2H₂O = 4HNO₃,可知丙中 n(NH₃) : n(O₂) = 1 : 2 时可完全被吸收生成 HNO₃,B 正确;若甲为 NaOH 或 CaO,则只能提供 NH₃,不能提供 O₂,C 正确;无水 CaCl₂能与 NH₃反应,不能选无水 CaCl₂做干燥剂,D 错误;溶液变红,说明已制得硝酸,A 正确。
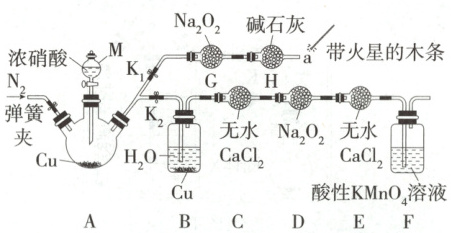
7.(2025江苏南京阶段练习)某学习兴趣小组探究$\mathrm{Na_2O_2}$与$\mathrm{NO_2}$、NO的反应,设计如图所示实验。
回答下列问题:
(1)盛放浓硝酸的仪器M的名称为
(2)$\mathrm{Na_2O_2}$与$\mathrm{NO_2}$反应,根据化合价升降原则有下列两种观点。
观点一:$\mathrm{Na_2O_2}$氧化$\mathrm{NO_2}$,生成$\mathrm{NaNO_3}$;
观点二:$\mathrm{NO_2}$氧化$\mathrm{Na_2O_2}$,生成$\mathrm{O_2}$。
为验证以上观点进行如下实验:
①关闭$\mathrm{K_2}$和弹簧夹,打开$\mathrm{K_1}$和A中仪器M的旋塞,再将带火星的木条放在a处,观察到
②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为
(3)丙同学根据NO易与$\mathrm{O_2}$反应,预测NO也易与$\mathrm{Na_2O_2}$反应。
①丙同学关闭$\mathrm{K_1}$,打开$\mathrm{K_2}$,用图中的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是
②装置B的作用为
③反应一段时间后,取装置D中产物少许,加入稀硫酸,产生无色气体,遇到空气变为红棕色。配平反应的化学方程式:6
④根据装置D中产物的判断结果,说明$\mathrm{Na_2O_2}$与NO的反应中$\mathrm{Na_2O_2}$的作用是
A.做氧化剂
B.做还原剂
C.既做氧化剂又做还原剂
回答下列问题:
(1)盛放浓硝酸的仪器M的名称为
分液漏斗
,A中发生的主要反应的离子方程式为Cu + 4H⁺ + 2NO₃⁻ = Cu²⁺ + 2NO₂↑ + 2H₂O
。(2)$\mathrm{Na_2O_2}$与$\mathrm{NO_2}$反应,根据化合价升降原则有下列两种观点。
观点一:$\mathrm{Na_2O_2}$氧化$\mathrm{NO_2}$,生成$\mathrm{NaNO_3}$;
观点二:$\mathrm{NO_2}$氧化$\mathrm{Na_2O_2}$,生成$\mathrm{O_2}$。
为验证以上观点进行如下实验:
①关闭$\mathrm{K_2}$和弹簧夹,打开$\mathrm{K_1}$和A中仪器M的旋塞,再将带火星的木条放在a处,观察到
红棕色气体迅速消失,带火星的木条复燃
,甲同学认为观点二正确。②乙同学认为该装置不能确认观点二正确,应在A、G之间增加一个装置,该装置的作用为
除去 NO₂中混有的水蒸气和硝酸
。改进后重复甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条没有复燃,判断观点一正确。(3)丙同学根据NO易与$\mathrm{O_2}$反应,预测NO也易与$\mathrm{Na_2O_2}$反应。
①丙同学关闭$\mathrm{K_1}$,打开$\mathrm{K_2}$,用图中的装置进行实验,为防止NO与空气中氧气反应,反应前的操作是
打开弹簧夹,通一段时间氮气
。②装置B的作用为
制取 NO
。③反应一段时间后,取装置D中产物少许,加入稀硫酸,产生无色气体,遇到空气变为红棕色。配平反应的化学方程式:6
NaNO₂
+3$\mathrm{H_2SO_4 \xlongequal{} 3Na_2SO_4+2HNO_3+}$4NO↑
+2$\mathrm{H_2O}$。④根据装置D中产物的判断结果,说明$\mathrm{Na_2O_2}$与NO的反应中$\mathrm{Na_2O_2}$的作用是
A
(填字母)。
A.做氧化剂
B.做还原剂
C.既做氧化剂又做还原剂
答案:
7.答案
(1)分液漏斗 Cu + 4H⁺ + 2NO₃⁻ = Cu²⁺ + 2NO₂↑ + 2H₂O
(2)①红棕色气体迅速消失,带火星的木条复燃 ②除去 NO₂中混有的水蒸气和硝酸
(3)①打开弹簧夹,通一段时间氮气 ②制取 NO ③NaNO₂ NO↑ ④A
解析
(1)盛放浓硝酸的仪器 M 的名称为分液漏斗;A 中主要发生铜与浓硝酸的反应,离子方程式为 Cu + 4H⁺ + 2NO₃⁻ = Cu²⁺ + 2NO₂↑ + 2H₂O。
(2)①关闭 K₂和弹簧夹,打开 K₁和 A 中仪器 M 的旋塞,若观点二正确,则产生的 NO₂与 Na₂O₂反应生成 O₂,所以观察到的现象为红棕色气体迅速消失,带火星的木条复燃。②产生的 NO₂中混有水蒸气和硝酸,故增加装置的作用是除去 NO₂中混有的水蒸气和硝酸。
(3)①装置中空气中的氧气易将产生的 NO 氧化,所以在产生 NO 前应先将装置中的空气排净,故反应前的操作是打开弹簧夹,通一段时间氮气。②因为 A 中反应主要产生 NO₂,本实验目的在于探究 NO 易与 Na₂O₂反应,所以装置 B 的作用为制取 NO。③根据实验现象“加入稀硫酸,产生无色气体,遇到空气变为红棕色”可知,还原产物为 NO,再根据原子守恒,得到缺少的反应物的化学式为 NaNO₂。④根据③中化学方程式可知,Na₂O₂与 NO 反应的产物为 NaNO₂,根据化合价变化可知,Na₂O₂中氧元素的化合价降低,故 Na₂O₂的作用是做氧化剂。
(1)分液漏斗 Cu + 4H⁺ + 2NO₃⁻ = Cu²⁺ + 2NO₂↑ + 2H₂O
(2)①红棕色气体迅速消失,带火星的木条复燃 ②除去 NO₂中混有的水蒸气和硝酸
(3)①打开弹簧夹,通一段时间氮气 ②制取 NO ③NaNO₂ NO↑ ④A
解析
(1)盛放浓硝酸的仪器 M 的名称为分液漏斗;A 中主要发生铜与浓硝酸的反应,离子方程式为 Cu + 4H⁺ + 2NO₃⁻ = Cu²⁺ + 2NO₂↑ + 2H₂O。
(2)①关闭 K₂和弹簧夹,打开 K₁和 A 中仪器 M 的旋塞,若观点二正确,则产生的 NO₂与 Na₂O₂反应生成 O₂,所以观察到的现象为红棕色气体迅速消失,带火星的木条复燃。②产生的 NO₂中混有水蒸气和硝酸,故增加装置的作用是除去 NO₂中混有的水蒸气和硝酸。
(3)①装置中空气中的氧气易将产生的 NO 氧化,所以在产生 NO 前应先将装置中的空气排净,故反应前的操作是打开弹簧夹,通一段时间氮气。②因为 A 中反应主要产生 NO₂,本实验目的在于探究 NO 易与 Na₂O₂反应,所以装置 B 的作用为制取 NO。③根据实验现象“加入稀硫酸,产生无色气体,遇到空气变为红棕色”可知,还原产物为 NO,再根据原子守恒,得到缺少的反应物的化学式为 NaNO₂。④根据③中化学方程式可知,Na₂O₂与 NO 反应的产物为 NaNO₂,根据化合价变化可知,Na₂O₂中氧元素的化合价降低,故 Na₂O₂的作用是做氧化剂。
查看更多完整答案,请扫码查看


