2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
5.(2025 江苏扬州第一中学月考)用石灰乳吸收硝酸工业尾气(含$\mathrm{NO}$、$\mathrm{NO_2}$)可获得$\mathrm{Ca(NO_2)_2}$,部分工艺流程如下:
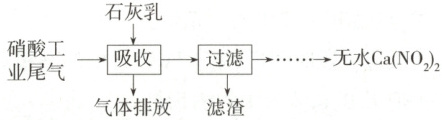
下列说法不正确的是 (
A.吸收时主要反应的化学方程式为$\mathrm{NO+NO_2+Ca(OH)_2\xlongequal{}Ca(NO_2)_2+H_2O}$
B.加快通入硝酸工业尾气的速率,可提高$\mathrm{NO}$、$\mathrm{NO_2}$的去除率
C.采用气液逆流的方式吸收尾气,有利于$\mathrm{NO}$、$\mathrm{NO_2}$的充分吸收
D.若尾气中$\frac{n(\mathrm{NO_2})}{n(\mathrm{NO})}<1$,处理后的尾气中$\mathrm{NO}$有剩余

下列说法不正确的是 (
B
)A.吸收时主要反应的化学方程式为$\mathrm{NO+NO_2+Ca(OH)_2\xlongequal{}Ca(NO_2)_2+H_2O}$
B.加快通入硝酸工业尾气的速率,可提高$\mathrm{NO}$、$\mathrm{NO_2}$的去除率
C.采用气液逆流的方式吸收尾气,有利于$\mathrm{NO}$、$\mathrm{NO_2}$的充分吸收
D.若尾气中$\frac{n(\mathrm{NO_2})}{n(\mathrm{NO})}<1$,处理后的尾气中$\mathrm{NO}$有剩余
答案:
5.B 根据工艺流程可知,$NO$、$NO_2$与氢氧化钙反应生成$Ca(NO_2)_2$,化学方程式为$NO + NO_2 + Ca(OH)_2 \longrightarrow Ca(NO_2)_2 + H_2O$,A正确;加快通入硝酸工业尾气的速率,反应可能不充分,$NO$、$NO_2$的去除率会降低,B错误;采用气液逆流的方式吸收尾气,反应物充分接触,有利于$NO$、$NO_2$的充分吸收,C正确;$NO$和氢氧化钙不反应,若尾气中$\frac{n(NO_2)}{n(NO)}<1$,发生反应$NO + NO_2 + Ca(OH)_2 \longrightarrow Ca(NO_2)_2 + H_2O$,$NO$有剩余,D正确。
6.(2025 北京八中期末)SCR 和 NSR 技术可有效降低柴油发动机在空气过量条件下的$\mathrm{NO_x}$排放。
(1)SCR(选择性催化还原)工作原理:
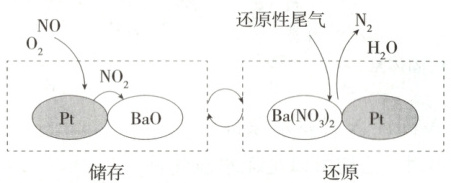
①尿素$\mathrm{[CO(NH_2)_2]}$水溶液热分解为$\mathrm{NH_3}$和$\mathrm{CO_2}$,该反应的化学方程式为
②反应器中$\mathrm{NH_3}$还原$\mathrm{NO_2}$的化学方程式为
③当燃油中含硫量较高时,尾气中$\mathrm{SO_2}$在$\mathrm{O_2}$作用下会形成$\mathrm{(NH_4)_2SO_4}$,使催化剂中毒,用化学方程式表示$\mathrm{(NH_4)_2SO_4}$的形成过程:
(2)NSR($\mathrm{NO_x}$储存还原)工作原理:
$\mathrm{NO_x}$的储存和还原在不同时段交替进行,如图所示。

①通过$\mathrm{BaO}$和$\mathrm{Ba(NO_3)_2}$的相互转化实现$\mathrm{NO_x}$的储存和还原,储存$\mathrm{NO_x}$的物质是
②用$\mathrm{H_2}$模拟尾气中还原性气体研究$\mathrm{Ba(NO_3)_2}$的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。
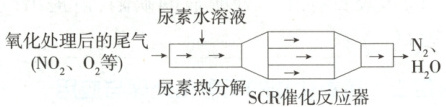
第一步反应消耗的$\mathrm{H_2}$与$\mathrm{Ba(NO_3)_2}$的物质的量之比是
③还原过程中,有时会产生笑气($\mathrm{N_2O}$)。用同位素示踪法研究发现笑气的产生与$\mathrm{NO}$有关。在有氧条件下$\mathrm{^{15}NO}$与$\mathrm{NH_3}$以一定比例反应时,得到的笑气几乎都是$\mathrm{^{15}NNO}$,除$\mathrm{^{15}NNO}$外还有水生成,则该反应的化学方程式为
提示:$\mathrm{^{15}N}$是氮原子的一种,原子核内质子数和中子数的和是 15,在反应前后原子核内质子数和中子数的和不变。
(1)SCR(选择性催化还原)工作原理:

①尿素$\mathrm{[CO(NH_2)_2]}$水溶液热分解为$\mathrm{NH_3}$和$\mathrm{CO_2}$,该反应的化学方程式为
$CO(NH_2)_2 + H_2O\stackrel{\triangle}{=}2NH_3↑ + CO_2↑$
。②反应器中$\mathrm{NH_3}$还原$\mathrm{NO_2}$的化学方程式为
$8NH_3 + 6NO_2\stackrel{催化剂}{=}7N_2 + 12H_2O$
。③当燃油中含硫量较高时,尾气中$\mathrm{SO_2}$在$\mathrm{O_2}$作用下会形成$\mathrm{(NH_4)_2SO_4}$,使催化剂中毒,用化学方程式表示$\mathrm{(NH_4)_2SO_4}$的形成过程:
$2SO_2 + O_2 + 4NH_3 + 2H_2O \longrightarrow 2(NH_4)_2SO_4$
。(省略反应条件)(2)NSR($\mathrm{NO_x}$储存还原)工作原理:
$\mathrm{NO_x}$的储存和还原在不同时段交替进行,如图所示。

①通过$\mathrm{BaO}$和$\mathrm{Ba(NO_3)_2}$的相互转化实现$\mathrm{NO_x}$的储存和还原,储存$\mathrm{NO_x}$的物质是
$BaO$
。②用$\mathrm{H_2}$模拟尾气中还原性气体研究$\mathrm{Ba(NO_3)_2}$的催化还原过程,该过程分两步进行,下图表示该过程相关物质浓度随时间的变化关系。

第一步反应消耗的$\mathrm{H_2}$与$\mathrm{Ba(NO_3)_2}$的物质的量之比是
8:1
。③还原过程中,有时会产生笑气($\mathrm{N_2O}$)。用同位素示踪法研究发现笑气的产生与$\mathrm{NO}$有关。在有氧条件下$\mathrm{^{15}NO}$与$\mathrm{NH_3}$以一定比例反应时,得到的笑气几乎都是$\mathrm{^{15}NNO}$,除$\mathrm{^{15}NNO}$外还有水生成,则该反应的化学方程式为
$4^{15}NO + 3O_2 + 4NH_3\stackrel{催化剂}{\underset{\triangle}{=}}4^{15}NNO + 6H_2O$
。提示:$\mathrm{^{15}N}$是氮原子的一种,原子核内质子数和中子数的和是 15,在反应前后原子核内质子数和中子数的和不变。
答案:
6.答案
(1)①$CO(NH_2)_2 + H_2O\stackrel{\triangle}{=}2NH_3↑ + CO_2↑$
②$8NH_3 + 6NO_2\stackrel{催化剂}{=}7N_2 + 12H_2O$ ③$2SO_2 + O_2 + 4NH_3 + 2H_2O \longrightarrow 2(NH_4)_2SO_4$
(2)①$BaO$ ②8:1 ③$4^{15}NO + 3O_2 + 4NH_3\stackrel{催化剂}{\underset{\triangle}{=}}4^{15}NNO + 6H_2O$
解析
(1)①尿素$[CO(NH_2)_2]$水溶液热分解为$NH_3$和$CO_2$,该反应的化学方程式为$CO(NH_2)_2 + H_2O\stackrel{\triangle}{=}2NH_3↑ + CO_2↑$。
②反应器中$NH_3$还原$NO_2$生成$N_2$和$H_2O$,$NH_3$具有还原性,发生反应的化学方程式为$8NH_3 + 6NO_2\stackrel{催化剂}{=}7N_2 + 12H_2O$。
③尾气中$SO_2$在$O_2$和$NH_3$作用下会形成$(NH_4)_2SO_4$,化学方程式为$2SO_2 + O_2 + 4NH_3 + 2H_2O \longrightarrow 2(NH_4)_2SO_4$。
(2)①由题图可知储存过程中,$NO$与$O_2$反应生成$NO_2$,发生反应的化学方程式为$2NO + O_2 \longrightarrow 2NO_2$,$BaO$和$NO_2$反应生成$Ba(NO_3)_2$,则储存$NO_x$的物质是$BaO$。
②由题图可知,第一步通入$H_2$与$Ba(NO_3)_2$反应后产生$NH_3$,则第一步反应的化学方程式为$8H_2 + Ba(NO_3)_2 \longrightarrow 2NH_3 + 5H_2O + BaO$,消耗的$H_2$与$Ba(NO_3)_2$的物质的量之比为8:1。
③有氧条件下,$^{15}NO$与$NH_3$以一定比例反应时,得到的$N_2O$几乎都是$^{15}NNO$,根据得失电子守恒和原子守恒,知反应的化学方程式为$4^{15}NO + 3O_2 + 4NH_3\stackrel{催化剂}{\underset{\triangle}{=}}4^{15}NNO + 6H_2O$。
(1)①$CO(NH_2)_2 + H_2O\stackrel{\triangle}{=}2NH_3↑ + CO_2↑$
②$8NH_3 + 6NO_2\stackrel{催化剂}{=}7N_2 + 12H_2O$ ③$2SO_2 + O_2 + 4NH_3 + 2H_2O \longrightarrow 2(NH_4)_2SO_4$
(2)①$BaO$ ②8:1 ③$4^{15}NO + 3O_2 + 4NH_3\stackrel{催化剂}{\underset{\triangle}{=}}4^{15}NNO + 6H_2O$
解析
(1)①尿素$[CO(NH_2)_2]$水溶液热分解为$NH_3$和$CO_2$,该反应的化学方程式为$CO(NH_2)_2 + H_2O\stackrel{\triangle}{=}2NH_3↑ + CO_2↑$。
②反应器中$NH_3$还原$NO_2$生成$N_2$和$H_2O$,$NH_3$具有还原性,发生反应的化学方程式为$8NH_3 + 6NO_2\stackrel{催化剂}{=}7N_2 + 12H_2O$。
③尾气中$SO_2$在$O_2$和$NH_3$作用下会形成$(NH_4)_2SO_4$,化学方程式为$2SO_2 + O_2 + 4NH_3 + 2H_2O \longrightarrow 2(NH_4)_2SO_4$。
(2)①由题图可知储存过程中,$NO$与$O_2$反应生成$NO_2$,发生反应的化学方程式为$2NO + O_2 \longrightarrow 2NO_2$,$BaO$和$NO_2$反应生成$Ba(NO_3)_2$,则储存$NO_x$的物质是$BaO$。
②由题图可知,第一步通入$H_2$与$Ba(NO_3)_2$反应后产生$NH_3$,则第一步反应的化学方程式为$8H_2 + Ba(NO_3)_2 \longrightarrow 2NH_3 + 5H_2O + BaO$,消耗的$H_2$与$Ba(NO_3)_2$的物质的量之比为8:1。
③有氧条件下,$^{15}NO$与$NH_3$以一定比例反应时,得到的$N_2O$几乎都是$^{15}NNO$,根据得失电子守恒和原子守恒,知反应的化学方程式为$4^{15}NO + 3O_2 + 4NH_3\stackrel{催化剂}{\underset{\triangle}{=}}4^{15}NNO + 6H_2O$。
查看更多完整答案,请扫码查看


