2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
4. (2025江苏扬州段考) 已知${H_{2}O_{2}(aq)}$分解为${H_{2}O(l)}$和${O_{2}(g)}$的能量变化如图中曲线$A$所示,若在${H_{2}O_{2}}$溶液中加入少量$KI$,则${H_{2}O_{2}}$的分解过程可表示为①${H_{2}O_{2} + I^{-}\xlongequal{}H_{2}O + IO^{-}}$,②${H_{2}O_{2} + IO^{-}\xlongequal{}H_{2}O + O_{2}\uparrow + I^{-}}$,其能量变化如图中曲线$B$所示。下列有关说法不正确的是 (
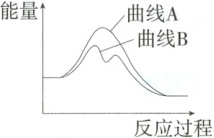
A.上述反应①为吸热反应,反应②为放热反应
B.$2\ \mathrm{mol}\ {H_{2}O_{2}(aq)}$具有的能量大于$2\ \mathrm{mol}\ {H_{2}O(l)}$和$1\ \mathrm{mol}\ {O_{2}(g)}$具有的总能量
C.${I^{-}}$在${H_{2}O_{2}}$分解过程中是催化剂
D.从曲线$B$可以看出,加入$KI$减少了${H_{2}O_{2}(aq)}$分解为${H_{2}O(l)}$和${O_{2}(g)}$的能量变化
D
)
A.上述反应①为吸热反应,反应②为放热反应
B.$2\ \mathrm{mol}\ {H_{2}O_{2}(aq)}$具有的能量大于$2\ \mathrm{mol}\ {H_{2}O(l)}$和$1\ \mathrm{mol}\ {O_{2}(g)}$具有的总能量
C.${I^{-}}$在${H_{2}O_{2}}$分解过程中是催化剂
D.从曲线$B$可以看出,加入$KI$减少了${H_{2}O_{2}(aq)}$分解为${H_{2}O(l)}$和${O_{2}(g)}$的能量变化
答案:
4.D 由题图可知,反应①生成物所具有的能量大于反应物所具有的能量,为吸热反应,反应②生成物所具有的能量小于反应物所具有的能量,为放热反应,A正确;H₂O₂(aq)分解生成H₂O(l)和O₂(g)的总反应为放热反应,故2molH₂O₂(aq)具有的能量大于2molH₂O(l)和1molO₂(g)具有的总能量,B正确;反应中I⁻被消耗又生成,在H₂O₂分解过程中是催化剂,C正确;催化剂改变反应速率,但是不改变反应物的总能量和生成物的总能量的差,D错误。
5. 某小组欲测定${KClO_{3}}$与${NaHSO_{3}}$溶液反应的化学反应速率。所用试剂为$10\ \mathrm{mL}\ 0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液和$10\ \mathrm{mL}\ 0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液,所得数据如图所示。
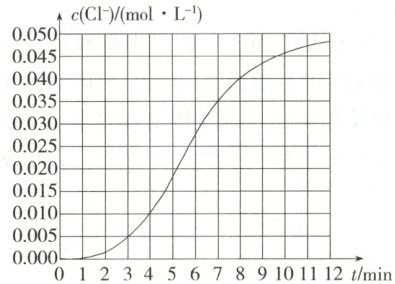
(1)写出两溶液混合反应的离子方程式:$\boldsymbol{$
(2)由实验数据可得,该反应在$0\sim4\ \mathrm{min}$的化学反应速率$v({NaHSO_{3}})$为$\boldsymbol{$
(3)该小组设计了3组实验探究影响化学反应速率的部分因素,具体情况如表所示。
| 实验编号 | 加入$0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液的体积/mL | 加入$0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液的体积/mL | 加入水的体积/mL | 反应温度/$^{\circ} C$ |
| --- | --- | --- | --- | --- |
| 1 | $10$ | $10$ | $0$ | $25$ |
| 2 | $10$ | $5$ | $a$ | $25$ |
| 3 | $10$ | $10$ | $0$ | $60$ |
表中$a=\boldsymbol{$
(4)某同学分析发现在反应过程中该反应的化学反应速率先增大后减小。针对此现象,该同学进一步通过测定$c({Cl^{-}})$随时间变化的曲线探究影响因素,具体如表所示。(已知${Na^{+}}$、${K^{+}}$对该反应速率无影响)
| 方案 | 假设 | 实验操作 |
| --- | --- | --- |
| Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入$10\ \mathrm{mL}\ 0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液和$10\ \mathrm{mL}\ 0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液,插入温度计测量温度 |
| Ⅱ | $\boldsymbol{$
| Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向$a$、$b\ 2$个烧杯中加入$10\ \mathrm{mL}\ 0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液,向烧杯$a$中加入$1\ \mathrm{mL}$水,向烧杯$b$中加入$1\ \mathrm{mL}\ 0.2\ \mathrm{mol· L^{-1}}$盐酸,再分别向$2$个烧杯中加入$10\ \mathrm{mL}\ 0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液 |
①方案Ⅱ中的假设为$\boldsymbol{$
②已知方案Ⅰ的假设不成立,某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:$\boldsymbol{$
③反应后期,化学反应速率变慢的原因是$\boldsymbol{$

(1)写出两溶液混合反应的离子方程式:$\boldsymbol{$
ClO₃⁻+3HSO₃⁻=3H⁺+Cl⁻+3SO₄²⁻
$}$。(2)由实验数据可得,该反应在$0\sim4\ \mathrm{min}$的化学反应速率$v({NaHSO_{3}})$为$\boldsymbol{$
0.0075mol·L⁻¹·min⁻¹
$}$。(3)该小组设计了3组实验探究影响化学反应速率的部分因素,具体情况如表所示。
| 实验编号 | 加入$0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液的体积/mL | 加入$0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液的体积/mL | 加入水的体积/mL | 反应温度/$^{\circ} C$ |
| --- | --- | --- | --- | --- |
| 1 | $10$ | $10$ | $0$ | $25$ |
| 2 | $10$ | $5$ | $a$ | $25$ |
| 3 | $10$ | $10$ | $0$ | $60$ |
表中$a=\boldsymbol{$
5
$}$,通过实验1和实验3可探究$\boldsymbol{$温度
$}$对化学反应速率的影响。(4)某同学分析发现在反应过程中该反应的化学反应速率先增大后减小。针对此现象,该同学进一步通过测定$c({Cl^{-}})$随时间变化的曲线探究影响因素,具体如表所示。(已知${Na^{+}}$、${K^{+}}$对该反应速率无影响)
| 方案 | 假设 | 实验操作 |
| --- | --- | --- |
| Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入$10\ \mathrm{mL}\ 0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液和$10\ \mathrm{mL}\ 0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液,插入温度计测量温度 |
| Ⅱ | $\boldsymbol{$
生成的氯离子加快了反应速率
$}$ | 取$10\ \mathrm{mL}\ 0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液加入烧杯中,向其中加入少量$NaCl$固体,再加入$10\ \mathrm{mL}\ 0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液 || Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向$a$、$b\ 2$个烧杯中加入$10\ \mathrm{mL}\ 0.1\ \mathrm{mol·\ L^{-1}}\ {KClO_{3}}$溶液,向烧杯$a$中加入$1\ \mathrm{mL}$水,向烧杯$b$中加入$1\ \mathrm{mL}\ 0.2\ \mathrm{mol· L^{-1}}$盐酸,再分别向$2$个烧杯中加入$10\ \mathrm{mL}\ 0.3\ \mathrm{mol·\ L^{-1}}\ {NaHSO_{3}}$溶液 |
①方案Ⅱ中的假设为$\boldsymbol{$
生成的氯离子加快了反应速率
$}$。②已知方案Ⅰ的假设不成立,某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:$\boldsymbol{$
将1mL水改为1mL0.2mol·L⁻¹NaCl溶液或KCl溶液
$}$。③反应后期,化学反应速率变慢的原因是$\boldsymbol{$
随着化学反应的进行,体系中的反应物浓度会逐渐降低,所以反应速率也会逐渐减慢
$}$。
答案:
5.答案
(1)ClO₃⁻+3HSO₃⁻=3H⁺+Cl⁻+3SO₄²⁻
(2)0.0075mol·L⁻¹·min⁻¹
(3)5温度
(4)①生成的氯离子加快了反应速率②将1mL水改为1mL0.2mol·L⁻¹NaCl溶液或KCl溶液③随着化学反应的进行,体系中的反应物浓度会逐渐降低,所以反应速率也会逐渐减慢
解析
(1)该反应为氧化还原反应,KClO₃中Cl元素的化合价降低,NaHSO₃中S元素的化合价升高,由得失电子守恒、电荷守恒及原子守恒可得该反应的离子方程式是ClO₃⁻+3HSO₃⁻=3H⁺+Cl⁻+3SO₄²⁻。
(2)该反应在0~4min的平均化学反应速率v(Cl⁻)=0.010mol·L⁻¹/4min=0.0025mol·L⁻¹·min⁻¹,由化学反应速率之比等于方程式中相应物质的化学计量数之比可得,v(NaHSO₃)=3v(Cl⁻)=0.0075mol·L⁻¹·min⁻¹。
(3)由实验1可知溶液的总体积为10mL+10mL=20mL,所以实验2中10+5+a=20,解得a=5;实验1和实验3的变量是温度,其他条件都相同,可探究温度对化学反应速率的影响。
(4)①根据题给信息可知,方案Ⅱ的假设为生成的Cl⁻对反应有催化作用,加快了反应速率。②方案Ⅲ中a、b两烧杯中H⁺和Cl⁻浓度都不同,变量不唯一,需要保持两个烧杯中除氢离子外参加反应的各离子浓度不变(不考虑Na⁺、K⁺),所以可以将1mL水改为1mL0.2mol·L⁻¹NaCl溶液或KCl溶液。③随着化学反应的进行,体系中反应物浓度会逐渐降低,浓度成为影响反应速率的主要因素,所以反应速率会逐渐减慢。
(1)ClO₃⁻+3HSO₃⁻=3H⁺+Cl⁻+3SO₄²⁻
(2)0.0075mol·L⁻¹·min⁻¹
(3)5温度
(4)①生成的氯离子加快了反应速率②将1mL水改为1mL0.2mol·L⁻¹NaCl溶液或KCl溶液③随着化学反应的进行,体系中的反应物浓度会逐渐降低,所以反应速率也会逐渐减慢
解析
(1)该反应为氧化还原反应,KClO₃中Cl元素的化合价降低,NaHSO₃中S元素的化合价升高,由得失电子守恒、电荷守恒及原子守恒可得该反应的离子方程式是ClO₃⁻+3HSO₃⁻=3H⁺+Cl⁻+3SO₄²⁻。
(2)该反应在0~4min的平均化学反应速率v(Cl⁻)=0.010mol·L⁻¹/4min=0.0025mol·L⁻¹·min⁻¹,由化学反应速率之比等于方程式中相应物质的化学计量数之比可得,v(NaHSO₃)=3v(Cl⁻)=0.0075mol·L⁻¹·min⁻¹。
(3)由实验1可知溶液的总体积为10mL+10mL=20mL,所以实验2中10+5+a=20,解得a=5;实验1和实验3的变量是温度,其他条件都相同,可探究温度对化学反应速率的影响。
(4)①根据题给信息可知,方案Ⅱ的假设为生成的Cl⁻对反应有催化作用,加快了反应速率。②方案Ⅲ中a、b两烧杯中H⁺和Cl⁻浓度都不同,变量不唯一,需要保持两个烧杯中除氢离子外参加反应的各离子浓度不变(不考虑Na⁺、K⁺),所以可以将1mL水改为1mL0.2mol·L⁻¹NaCl溶液或KCl溶液。③随着化学反应的进行,体系中反应物浓度会逐渐降低,浓度成为影响反应速率的主要因素,所以反应速率会逐渐减慢。
查看更多完整答案,请扫码查看


