2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
1. 从邮轮首航到电动飞机首飞再到航天首发,我国一批科技创新实现新的突破。下列说法不正确的是 (
A.“天目一号”气象星座卫星的光伏发电系统工作时可将化学能转化为电能
B.“快舟一号甲”运载火箭利用燃料与氧化剂反应放热并产生大量气体实现助推
C.“爱达·魔都号”邮轮使用的镁铝合金具有密度低、抗腐蚀性强的特点
D.“AG60E”电动飞机使用的动力型锂电池具有质量轻、比能量高的特点
A
)A.“天目一号”气象星座卫星的光伏发电系统工作时可将化学能转化为电能
B.“快舟一号甲”运载火箭利用燃料与氧化剂反应放热并产生大量气体实现助推
C.“爱达·魔都号”邮轮使用的镁铝合金具有密度低、抗腐蚀性强的特点
D.“AG60E”电动飞机使用的动力型锂电池具有质量轻、比能量高的特点
答案:
1.A 光伏发电系统工作时将光能转化为电能,A错误;运载火箭利用燃料与氧化剂反应放热并产生大量气体实现助推,B正确;镁铝合金具有密度低、抗腐蚀性强的特点,C正确;锂电池具有质量轻、体积小、比能量高的特点,D正确。
2. 已知反应 A(g)+3B(g)⇌2C(g)+2D(g),在不同情况下测得反应速率,其中反应最快的是 (
A.v(A)=0.5 mol/(L·min)
B.v(B)=1.2 mol/(L·min)
C.v(C)=0.9 mol/(L·min)
D.v(D)=0.8 mol/(L·min)
A
)A.v(A)=0.5 mol/(L·min)
B.v(B)=1.2 mol/(L·min)
C.v(C)=0.9 mol/(L·min)
D.v(D)=0.8 mol/(L·min)
答案:
2.A 把在不同情况下测得的B、C、D表示的反应速率换算成v(A)再进行比较。B项,v(A)=1.2mol/(L·min)÷3 = 0.4mol/(L·min); C项,v(A)=0.9mol/(L·min)÷2 = 0.45mol/(L·min);D项,v(A)= 0.8mol/(L·min)÷2 = 0.4mol/(L·min);则A项符合题意。
3. 为减少目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是 (
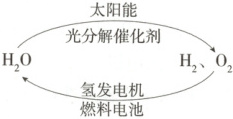
A.H₂O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H₂O具有的总能量低于2 mol H₂和1 mol O₂的能量
D.氢气不易贮存和运输,无开发利用价值
C
)
A.H₂O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol H₂O具有的总能量低于2 mol H₂和1 mol O₂的能量
D.氢气不易贮存和运输,无开发利用价值
答案:
3.C H₂O的分解反应是吸热反应,故A错误;通过电解水制备氢气,耗费大量电能,廉价制氢技术采用太阳能分解水,但技术不成熟,是制约氢气大量生产的原因,氢能源未被普遍使用,故B错误;H₂O的分解反应是吸热反应,可知2molH₂O具有的总能量低于2molH₂和1molO₂的能量,故C正确;氢气的燃烧产物是水,不污染环境,所以氢能具有开发利用价值,故D错误。
4. 比较X、Y、Z、W四种金属的活动性,方案及相关现象如下:
① 将四种金属各自浸入稀硫酸中,只有W表面无气泡产生;
② 将X、Y用导线连接浸入稀硫酸中,X上产生气泡;
③ 将Y、Z用导线连接浸入稀硫酸中,Z质量减轻。
则这四种金属的活动性由强到弱的顺序为 (
A.Z>Y>X>W
B.Z>X>Y>W
C.Z>Y>W>X
D.Y>Z>X>W
① 将四种金属各自浸入稀硫酸中,只有W表面无气泡产生;
② 将X、Y用导线连接浸入稀硫酸中,X上产生气泡;
③ 将Y、Z用导线连接浸入稀硫酸中,Z质量减轻。
则这四种金属的活动性由强到弱的顺序为 (
A
)A.Z>Y>X>W
B.Z>X>Y>W
C.Z>Y>W>X
D.Y>Z>X>W
答案:
4.A 根据①可知,W的金属活动性最弱;根据②可知X为原电池正极,Y为原电池负极,说明金属活动性:Y>X;根据③可知Z为原电池负极,Y为原电池正极,说明金属活动性:Z>Y。综上可知金属活动性:Z>Y>X>W,A正确。
5. 下列关于化学反应速率的说法错误的是 (
A.恒容密闭容器中,存在反应H₂(g)+S(s)⇌H₂S(g),充入He,化学反应速率不变
B.锌与稀硫酸反应时,加入氯化钠溶液,化学反应速率减小
C.实验制氯气时,增加二氧化锰的用量,能加快反应速率
D.恒容密闭容器中,存在反应2NO(g)+O₂(g)⇌2NO₂(g),升高温度,正、逆反应速率都增大
C
)A.恒容密闭容器中,存在反应H₂(g)+S(s)⇌H₂S(g),充入He,化学反应速率不变
B.锌与稀硫酸反应时,加入氯化钠溶液,化学反应速率减小
C.实验制氯气时,增加二氧化锰的用量,能加快反应速率
D.恒容密闭容器中,存在反应2NO(g)+O₂(g)⇌2NO₂(g),升高温度,正、逆反应速率都增大
答案:
5.C 恒容密闭容器内存在反应H₂(g)+S(s)⇌H₂S(g),充入He,反应物浓度不变,对反应速率无影响,故A正确;锌与稀硫酸反应,反应实质为Zn + 2H⁺ = Zn²⁺ + H₂↑,加入氯化钠溶液,氢离子浓度减小,反应速率减小,B正确;二氧化锰是固体,制氯气时,增加二氧化锰的用量,反应物浓度不变,反应速率不变,C错误;升高温度,正、逆反应速率都增大,故D正确。
6. NO₂与SO₂之间能发生反应:
SO₂(g)+NO₂(g)⇌SO₃(g)+NO(g) ΔH₁=-41.8 kJ·mol⁻¹。
SO₂(g)+NO₂(g)⇌SO₃(s)+NO(g) ΔH₂=-Q kJ·mol⁻¹。
下列有关说法正确的是 (
A.Q<41.8
B.增大压强能使SO₂全部转化为SO₃
C.SO₂的生成速率和NO的消耗速率相等说明反应达到平衡状态
D.该反应中每生成22.4 L NO(标准状况下)转移电子的数目约等于2×6.02×10²³
SO₂(g)+NO₂(g)⇌SO₃(g)+NO(g) ΔH₁=-41.8 kJ·mol⁻¹。
SO₂(g)+NO₂(g)⇌SO₃(s)+NO(g) ΔH₂=-Q kJ·mol⁻¹。
下列有关说法正确的是 (
D
)A.Q<41.8
B.增大压强能使SO₂全部转化为SO₃
C.SO₂的生成速率和NO的消耗速率相等说明反应达到平衡状态
D.该反应中每生成22.4 L NO(标准状况下)转移电子的数目约等于2×6.02×10²³
答案:
6.D SO₂(g)的能量比等质量的SO₂(s)的能量高,故SO₂(g)+NO₂(g)⇌SO₃(s)+NO(g)的△H₂< - 41.8kJ/mol,即Q>41.8,A错误;可逆反应转化率不可能达到100%,增大压强不能使SO₂全部转化为SO₃,B错误; SO₂的生成速率和NO的消耗速率相等,反应不一定达到平衡状态,C错误;反应中N元素由 + 4价降低为 + 2价,标准状况下,该反应中每生成22.4LNO转移电子的数目约为$\frac{22.4L}{22.4L/mol}$×2×6.02×10²³/mol = 2×6.02×10²³,D正确。
查看更多完整答案,请扫码查看


