2025年5年高考3年模拟高中化学必修第二册苏教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年5年高考3年模拟高中化学必修第二册苏教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第49页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
11. (2025 浙江1月选考,16)蛋白质中$N$元素含量可按下列步骤测定:

下列说法
A.步骤Ⅰ,须加入过量浓${H_{2}SO_{4}}$,以确保$N$元素完全转化为${NH^{+}_{4}}$
B.步骤Ⅱ,浓$NaOH$溶液过量,有利于氨的蒸出
C.步骤Ⅲ,用定量、过量盐酸标准溶液吸收${NH_{3}}$,以甲基红(变色的$pH$范围:$4.4\sim_{6}.2$)为指示剂,用$NaOH$标准溶液滴定,经计算可得$N$元素的含量
D.尿素${[CO(NH_{2})_{2}]}$样品、${NaNO_{3}}$样品的$N$元素含量均可按上述步骤测定

下列说法
不
正
确
的是 (D
)A.步骤Ⅰ,须加入过量浓${H_{2}SO_{4}}$,以确保$N$元素完全转化为${NH^{+}_{4}}$
B.步骤Ⅱ,浓$NaOH$溶液过量,有利于氨的蒸出
C.步骤Ⅲ,用定量、过量盐酸标准溶液吸收${NH_{3}}$,以甲基红(变色的$pH$范围:$4.4\sim_{6}.2$)为指示剂,用$NaOH$标准溶液滴定,经计算可得$N$元素的含量
D.尿素${[CO(NH_{2})_{2}]}$样品、${NaNO_{3}}$样品的$N$元素含量均可按上述步骤测定
答案:
11.D 步骤I中加入过量的浓硫酸可将蛋白质中的N元素完全转化为NH₄⁺,A正确。向煮解液中加入过量的浓NaOH溶液,促进平衡NH₄⁺+OH⁻⇌NH₃·H₂O正向移动,有利于NH₃的蒸出,B正确。用定量、过量盐酸标准溶液吸收NH₃,生成NH₄Cl,溶液中溶质为NH₄Cl和HCl,接着用NaOH标准溶液滴定多余的盐酸,此时NH₄Cl不反应,等指示剂变色时多余的盐酸完全反应,溶液中溶质为NH₄Cl和NaCl;用定量、过量盐酸标准溶液中的n(HCl)减去所用NaOH标准溶液中的n(NaOH)即得到生成的n(NH₄Cl),根据N原子守恒,可得出蛋白质中N元素的量,进而计算蛋白质中N元素的含量,C正确。若按题述步骤测定NaNO₃样品,在步骤I中NaNO₃样品遇到浓硫酸会转化为HNO₃,而不是NH₄⁺,故不能用该方法测定NaNO₃样品中N元素的含量,D错误。
1. 经典真题 (2022 江苏高考)氮及其化合物的转化具有重要应用。下列说法
A.自然固氮、人工固氮都是将${N_{2}}$转化为${NH_{3}}$
B.侯氏制碱法以${H_{2}O}$、${NH_{3}}$、${CO_{2}}$、$NaCl$为原料制备${NaHCO_{3}}$和${NH_{4}Cl}$
C.工业上通过${NH_{3}}$催化氧化等反应过程生产${HNO_{3}}$
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
不
正
确
的是 (A
)A.自然固氮、人工固氮都是将${N_{2}}$转化为${NH_{3}}$
B.侯氏制碱法以${H_{2}O}$、${NH_{3}}$、${CO_{2}}$、$NaCl$为原料制备${NaHCO_{3}}$和${NH_{4}Cl}$
C.工业上通过${NH_{3}}$催化氧化等反应过程生产${HNO_{3}}$
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
答案:
1.A 自然固氮是将N₂转化为含氮化合物,不一定是转化为NH₃,A错误;侯氏制碱法以H₂O、NH₃、CO₂、NaCl为原料制备NaHCO₃和NH₄Cl,反应的化学方程式为H₂O+NH₃+CO₂+NaCl=NaHCO₃↓+NH₄Cl,B正确;工业上通过NH₃催化氧化等反应生产HNO₃,相关的化学方程式为4NH₃+5O₂$\xlongequal[△]{催化剂}$4NO+6H₂O、2NO+O₂=2NO₂、3NO₂+H₂O=2HNO₃+NO,C正确;氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,D正确。
2. (2025 浙江金砖高中联盟期中)为落实“五水共治”,某工厂拟综合处理含${NH^{+}_{4}}$的废水和工业废气(主要含${N_{2}}$、${CO_{2}}$、${SO_{2}}$、$NO$、$CO$,不考虑其他成分),设计了如下流程:
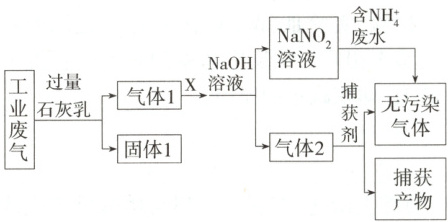
已知:${NO + NO_{2} + 2NaOH\xlongequal{} 2NaNO_{2} + H_{2}O}$;${2NO_{2} + 2NaOH\xlongequal{} NaNO_{3} + NaNO_{2} + H_{2}O}$
下列说法不正确的是 (
A.$X$可以是空气,且需过量
B.固体1中主要含有${Ca(OH)_{2}}$、${CaCO_{3}}$、${CaSO_{3}}$
C.捕获剂所捕获的气体主要是$CO$
D.处理含${NH^{+}_{4}}$废水时,发生反应的离子方程式为${NH^{+}_{4} + NO^{-}_{2}\xlongequal{} N_{2}\uparrow + 2H_{2}O}$

已知:${NO + NO_{2} + 2NaOH\xlongequal{} 2NaNO_{2} + H_{2}O}$;${2NO_{2} + 2NaOH\xlongequal{} NaNO_{3} + NaNO_{2} + H_{2}O}$
下列说法不正确的是 (
A
)A.$X$可以是空气,且需过量
B.固体1中主要含有${Ca(OH)_{2}}$、${CaCO_{3}}$、${CaSO_{3}}$
C.捕获剂所捕获的气体主要是$CO$
D.处理含${NH^{+}_{4}}$废水时,发生反应的离子方程式为${NH^{+}_{4} + NO^{-}_{2}\xlongequal{} N_{2}\uparrow + 2H_{2}O}$
答案:
2.A 工业废气通入过量石灰乳中,CO₂、SO₂分别和石灰乳反应生成碳酸钙、亚硫酸钙;气体1主要是N₂、NO、CO,X与NO反应的产物与氢氧化钠溶液反应生成亚硝酸钠,NO₂和NH₄⁺反应生成氮气;气体2主要是氮气和CO,经过捕获剂得到无污染的氮气和捕获产物。X可以是空气,空气中的氧气将NO部分氧化为NO₂,NO₂、NO的混合气体和氢氧化钠溶液反应生成亚硝酸钠,但氧气不能过量,否则用NaOH溶液吸收生成亚硝酸钠与硝酸钠的混合溶液,A错误;根据上述分析可知,固体1中主要含有Ca(OH)₂、CaCO₃、CaSO₃,B正确;根据上述分析可知,捕获剂捕获的气体主要是CO,C正确;处理含NH₄⁺废水时,NO₂⁻和NH₄⁺反应生成无污染的气体,反应的离子方程式为NH₄⁺+NO₂⁻=N₂↑+2H₂O,D正确。
3. (2025 江西赣州南康中学阶段检测)某同学进行如下实验:
|装置|操作|现象|
| ---- | ---- | ---- |
| |将盛有浓硝酸的烧杯$A$放入盛有淀粉$KI$溶液的烧杯$C$中,然后将铜片放入烧杯$A$中,立即用烧杯$B$罩住|烧杯$A$液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯$A$和$C$中的液体都变成蓝色|
|将盛有浓硝酸的烧杯$A$放入盛有淀粉$KI$溶液的烧杯$C$中,然后将铜片放入烧杯$A$中,立即用烧杯$B$罩住|烧杯$A$液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯$A$和$C$中的液体都变成蓝色|
下列说法合理的是 (
A.烧杯$A$中开始阶段发生反应:${3Cu + 8HNO_{3}\xlongequal{} 3Cu(NO_{3})_{2} + 2NO\uparrow + 4H_{2}O}$
B.红棕色气体消失只与${NO_{2}}$和烧杯$C$中的$KI$发生反应有关
C.若将铜片换成铁片,则$C$中的液体也可能变蓝
D.烧杯$C$中溶液变蓝只与${NO_{2}}$和$C$中溶液发生反应有关
|装置|操作|现象|
| ---- | ---- | ---- |
|
 |将盛有浓硝酸的烧杯$A$放入盛有淀粉$KI$溶液的烧杯$C$中,然后将铜片放入烧杯$A$中,立即用烧杯$B$罩住|烧杯$A$液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯$A$和$C$中的液体都变成蓝色|
|将盛有浓硝酸的烧杯$A$放入盛有淀粉$KI$溶液的烧杯$C$中,然后将铜片放入烧杯$A$中,立即用烧杯$B$罩住|烧杯$A$液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯$A$和$C$中的液体都变成蓝色|下列说法合理的是 (
C
)A.烧杯$A$中开始阶段发生反应:${3Cu + 8HNO_{3}\xlongequal{} 3Cu(NO_{3})_{2} + 2NO\uparrow + 4H_{2}O}$
B.红棕色气体消失只与${NO_{2}}$和烧杯$C$中的$KI$发生反应有关
C.若将铜片换成铁片,则$C$中的液体也可能变蓝
D.烧杯$C$中溶液变蓝只与${NO_{2}}$和$C$中溶液发生反应有关
答案:
3.C 烧杯A中铜与浓硝酸反应的化学方程式为Cu+4HNO₃(浓)=Cu(NO₃)₂+2NO₂↑+2H₂O,A错误;红棕色气体消失与NO₂和烧杯C中的KI发生反应有关,也与NO₂和水反应有关,B错误;若将铜片换成铁片,铁在常温下遇浓硝酸会发生钝化,但浓硝酸具有挥发性,挥发的HNO₃也能将烧杯C中的KI氧化产生I₂,C正确,D错误。
查看更多完整答案,请扫码查看


