第98页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
7. 如图,四名同学正在讨论某一个化学方程式的意义,他们所描述的化学方程式是(
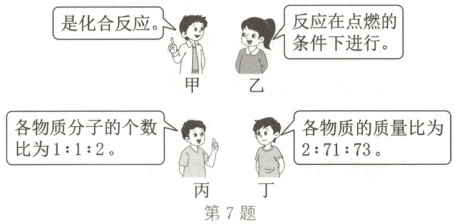
A.$C + O_{2}\stackrel{点燃}{=\!=\!=}CO_{2}$
B.$2CO + O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2}$
C.$H_{2} + Cl_{2}\stackrel{点燃}{=\!=\!=}2HCl$
D.$2Mg + O_{2}\stackrel{点燃}{=\!=\!=}2MgO$
C
)
A.$C + O_{2}\stackrel{点燃}{=\!=\!=}CO_{2}$
B.$2CO + O_{2}\stackrel{点燃}{=\!=\!=}2CO_{2}$
C.$H_{2} + Cl_{2}\stackrel{点燃}{=\!=\!=}2HCl$
D.$2Mg + O_{2}\stackrel{点燃}{=\!=\!=}2MgO$
答案:
7. C
8. 写出下列叙述涉及的化学方程式。
(1)氢能源因热值高、零污染、制氢原料丰富而成为未来最理想的燃料:
(2)工业上常采用煅烧石灰石(主要成分为$CaCO_{3}$)的方法制取生石灰($CaO$),同时生成二氧化碳:
(3)在尘埃的作用下,二氧化硫和氧气反应生成三氧化硫($SO_{3}$):
(4)一氧化碳和四氧化三铁在高温下反应,生成铁和二氧化碳:
(1)氢能源因热值高、零污染、制氢原料丰富而成为未来最理想的燃料:
2H₂ + O₂$\stackrel{点燃}{=\!=\!=}$2H₂O
。(2)工业上常采用煅烧石灰石(主要成分为$CaCO_{3}$)的方法制取生石灰($CaO$),同时生成二氧化碳:
CaCO₃$\stackrel{高温}{=\!=\!=}$CaO + CO₂↑
。(3)在尘埃的作用下,二氧化硫和氧气反应生成三氧化硫($SO_{3}$):
2SO₂ + O₂$\stackrel{尘埃}{=\!=\!=}$2SO₃
。(4)一氧化碳和四氧化三铁在高温下反应,生成铁和二氧化碳:
4CO + Fe₃O₄$\stackrel{高温}{=\!=\!=}$3Fe + 4CO₂
。
答案:
8.
(1)2H₂ + O₂$\stackrel{点燃}{=\!=\!=}$2H₂O
(2)CaCO₃$\stackrel{高温}{=\!=\!=}$CaO + CO₂↑
(3)2SO₂ + O₂$\stackrel{尘埃}{=\!=\!=}$2SO₃
(4)4CO + Fe₃O₄$\stackrel{高温}{=\!=\!=}$3Fe + 4CO₂
(1)2H₂ + O₂$\stackrel{点燃}{=\!=\!=}$2H₂O
(2)CaCO₃$\stackrel{高温}{=\!=\!=}$CaO + CO₂↑
(3)2SO₂ + O₂$\stackrel{尘埃}{=\!=\!=}$2SO₃
(4)4CO + Fe₃O₄$\stackrel{高温}{=\!=\!=}$3Fe + 4CO₂
9. 2024年10月30日,“神舟十九号”载人飞船成功对接空间站“天和”核心舱。空间站内利用物质的转化使$O_{2}$和$CO_{2}$的含量保持相对稳定。
(1)航天员呼吸所需的$O_{2}$来自水的电解,其反应的化学方程式是
(2)航天员呼吸产生的$CO_{2}$进行转化时,其反应的微观示意图如图:
该反应的化学方程式为____。参加反应的A和B的质量比为____(填最简整数比)。
]
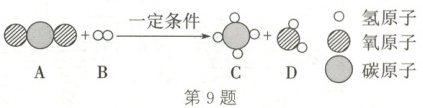
(1)航天员呼吸所需的$O_{2}$来自水的电解,其反应的化学方程式是
2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑
。(2)航天员呼吸产生的$CO_{2}$进行转化时,其反应的微观示意图如图:
该反应的化学方程式为____。参加反应的A和B的质量比为____(填最简整数比)。
]

答案:
9.
(1)2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑
(2)CO₂ + 4H₂$\stackrel{一定条件}{=\!=\!=}$CH₄ + 2H₂O 11:2
(1)2H₂O$\stackrel{通电}{=\!=\!=}$2H₂↑ + O₂↑
(2)CO₂ + 4H₂$\stackrel{一定条件}{=\!=\!=}$CH₄ + 2H₂O 11:2
10. (2025·晋中寿阳段考)某工厂以软锰矿(主要成分为$MnO_{2}$)为原料,生产高锰酸钾的流程如图所示。请回答下列问题:
(1)流程中生成高锰酸钾反应的化学方程式为$aK_{2}MnO_{4} + 2CO_{2}\xlongequal{}2KMnO_{4} + 2K_{2}CO_{3} + MnO_{2}$,其中$a$的值为
(2)通过浓缩结晶得到高锰酸钾粗晶体的过程中,要控制好温度,防止温度过高使高锰酸钾发生分解,写出高锰酸钾发生分解反应的化学方程式:____。
(3)生产流程中可循环利用的两种物质是
考点四 根据化学方程式的计算
]
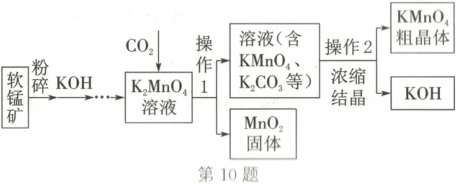
(1)流程中生成高锰酸钾反应的化学方程式为$aK_{2}MnO_{4} + 2CO_{2}\xlongequal{}2KMnO_{4} + 2K_{2}CO_{3} + MnO_{2}$,其中$a$的值为
3
。(2)通过浓缩结晶得到高锰酸钾粗晶体的过程中,要控制好温度,防止温度过高使高锰酸钾发生分解,写出高锰酸钾发生分解反应的化学方程式:____。
(3)生产流程中可循环利用的两种物质是
MnO₂、KOH
(填化学式)。考点四 根据化学方程式的计算
]

答案:
10.
(1)3
(2)2KMnO₄$\stackrel{\triangle}{=\!=\!=}$K₂MnO₄ + MnO₂ + O₂↑
(3)MnO₂、KOH 解析:
(1)根据质量守恒定律,反应前后原子的个数相等,反应后钾原子的个数也为6,则反应前钾原子的个数也为6,故a = 3。
(2)高锰酸钾受热生成锰酸钾、二氧化锰、氧气,反应的化学方程式为2KMnO₄$\stackrel{\triangle}{=\!=\!=}$K₂MnO₄ + MnO₂ + O₂↑。
(3)在流程刚开始时加入了软锰矿和氢氧化钾,而后反应又生成了二氧化锰和氢氧化钾,所以流程中可循环利用的物质是二氧化锰和氢氧化钾,化学式为MnO₂、KOH。
(1)3
(2)2KMnO₄$\stackrel{\triangle}{=\!=\!=}$K₂MnO₄ + MnO₂ + O₂↑
(3)MnO₂、KOH 解析:
(1)根据质量守恒定律,反应前后原子的个数相等,反应后钾原子的个数也为6,则反应前钾原子的个数也为6,故a = 3。
(2)高锰酸钾受热生成锰酸钾、二氧化锰、氧气,反应的化学方程式为2KMnO₄$\stackrel{\triangle}{=\!=\!=}$K₂MnO₄ + MnO₂ + O₂↑。
(3)在流程刚开始时加入了软锰矿和氢氧化钾,而后反应又生成了二氧化锰和氢氧化钾,所以流程中可循环利用的物质是二氧化锰和氢氧化钾,化学式为MnO₂、KOH。
11. (2025·晋中寿阳段考)在反应$3A + 3B\xlongequal{}C + 3D$中,已知68g A与40g B恰好完全反应,生成24g C;若A的相对分子质量为136,则D的相对分子质量为(
A.168
B.126
C.336
D.252
A
)A.168
B.126
C.336
D.252
答案:
11. A 解析:根据质量守恒定律,反应生成D的质量为68g + 40g - 24g = 84g。设D的相对分子质量为x。
3A + 3B =\!=\!= C + 3D
136×3 3x
68g 84g
$\frac{136×3}{68g}$=$\frac{3x}{84g}$ x = 168
3A + 3B =\!=\!= C + 3D
136×3 3x
68g 84g
$\frac{136×3}{68g}$=$\frac{3x}{84g}$ x = 168
12. 某化学反应在密闭容器中进行,各物质的分子数目、质量随时间的变化情况如图①、图②所示。下列说法错误的是(

A.$Z$一定属于化合物
B.参加反应的$X$与$Y$的质量比为$3:14$
C.反应前后分子总数不变
D.$Y$与$Z$的相对分子质量之比为$28:17$
C
)
A.$Z$一定属于化合物
B.参加反应的$X$与$Y$的质量比为$3:14$
C.反应前后分子总数不变
D.$Y$与$Z$的相对分子质量之比为$28:17$
答案:
12. C 解析:由图①可知,X和Y是反应物,Z是生成物,由分子数目的变化情况可知,该反应可表示为3X + Y =\!=\!= 2Z。由图②可知,t s时参加反应的Y的质量为72g - 44g = 28g,生成Z的质量为34g,则t s时参加反应的X的质量为34g - 28g = 6g。由该反应的化学方程式3X + Y =\!=\!= 2Z可知,该反应属于化合反应,因此生成物Z一定是化合物,A正确;参加反应的X与Y的质量比为6g:28g = 3:14,B正确;由化学方程式可知,反应前后分子总数改变,C错误;设Y、Z的相对分子质量分别为x、y,由化学方程式可知,$\frac{x}{2y}$=$\frac{28g}{34g}$,则$\frac{x}{y}$=$\frac{28}{17}$,D正确。故本题选C。
查看更多完整答案,请扫码查看


